Определения понятия портосистемных шунтов у собак
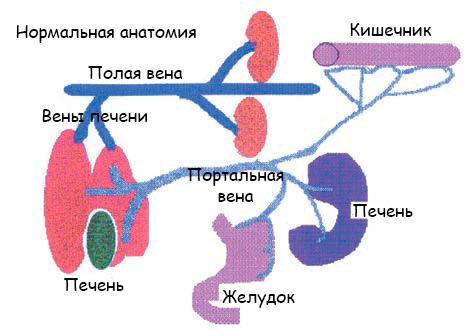
Печеночным шунтом у собак называют аномальный сосуд, который соединяет портальную вену или ее ветви с системным кровотоком (рисунок 1B-D). Через аномальный сосуд (шунт), венозная кровь из желудочно-кишечного тракта, поджелудочной железы и селезенки, поступает в системный кровоток, а не печень.
В результате, различные токсины (например, аммиак), которые всасываются с пищей в желудочно-кишечном тракте, не метаболизируются в печени, а обходят ее через шунтирующий сосуд. Помимо этого, различные факторы роста не поступают в печень из желудочно-кишечного тракта и поджелудочной железы, что приводит к атрофии паренхимы печени, снижению ее функции и синтеза протеинов, и в итоге, развитию печеночной недостаточности.
- Портосистемный или печеночный шунт — аномальный сосуд, который соединяет портальный кровоток с системным венозным кровообращением в обход печени;
- Портокавальный шунт — аномальный сосуд, который соединяет между собой портальную и каудальную полую вены, является разновидностью портосистемного шунта.
Синонимы: портосистемный шунт, печеночный шунт.
Сокращения: ПСШ — портосистемный шунт; ЖКТ — желудочно-кишечный тракт; ПЭ — печеночная энцефалопатия; ЦНС – центральная нервная система; ПГ – портальная гипертензия; КТ – компьютерная томография; ПТВ — протромбиновое время; АЧТВ — активированное частичное тромбопластиновое время; ЖК — желчные кислоты, УЗИ — ультразвуковое исследование, МРТ — магнитно-резонансная томография.
Шунты у собак подразделяют на врожденные и приобретенные. В этой статье рассматриваются, только врожденные печеночные или портосистемные шунты у собак. Приобретенные шунты (рисунок 1D), развиваются у животных вторично, из-за патологий печени или портальной системы кровотока, и будут рассмотрены отдельно.
Оглавление
(A) Нормальная анатомия венозной системы у собаки
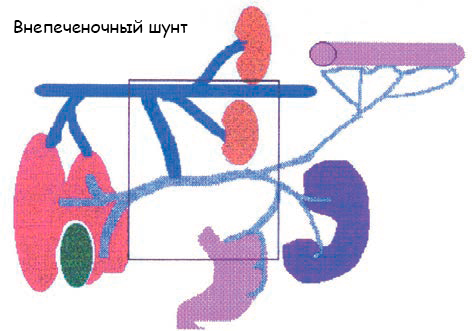
(B) Внепеченочный портосистемный шунт (обозначен квадратом)
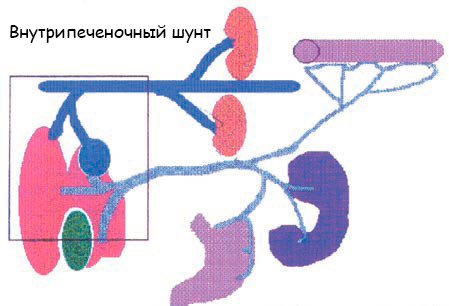
(C) Внутрипеченочный шунт (обозначен квадратом)
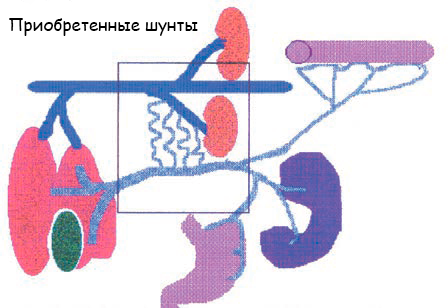
(D) Множественные приобретенные шунты у собаки
Рисунок 1. Схематичное изображение портального кровотока у собаки: норма (А), внепеченочный шунт (B), внутрипеченочный шунт (C) и приобретенные шунты (D).
Врожденные печеночные или портосистемные шунты (ПСШ) у собак, развиваются внутриутробно и функционируют после рождения. Врожденные портосистемные шунты подразделяют на две группы:
- Внепеченочные ПСШ (рисунок 1B);
- Внутрипеченочные ПСШ (рисунок 1C).
У мелких и карликовых пород собак обычно диагностируют внепеченочные ПСШ, а у крупных и гигантских пород — внутрипеченочные ПСШ.
Анатомия портальной системы у собак
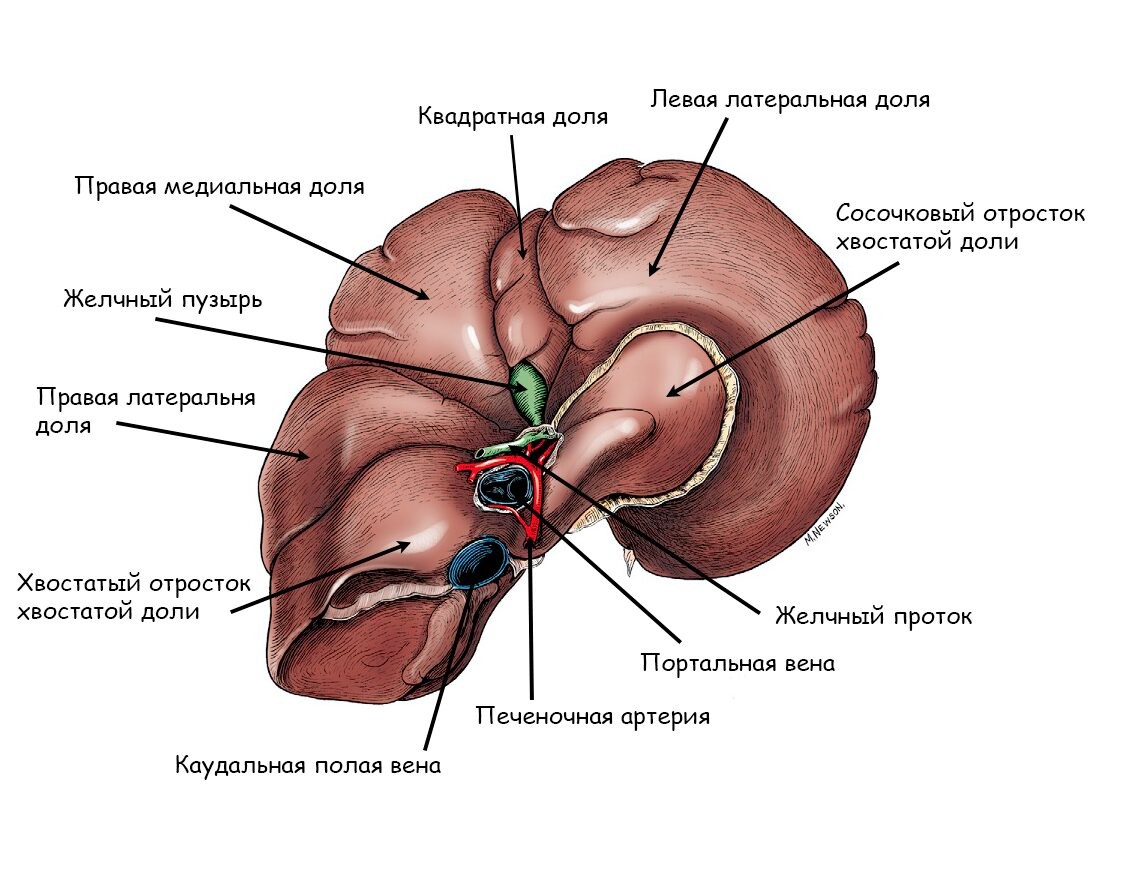
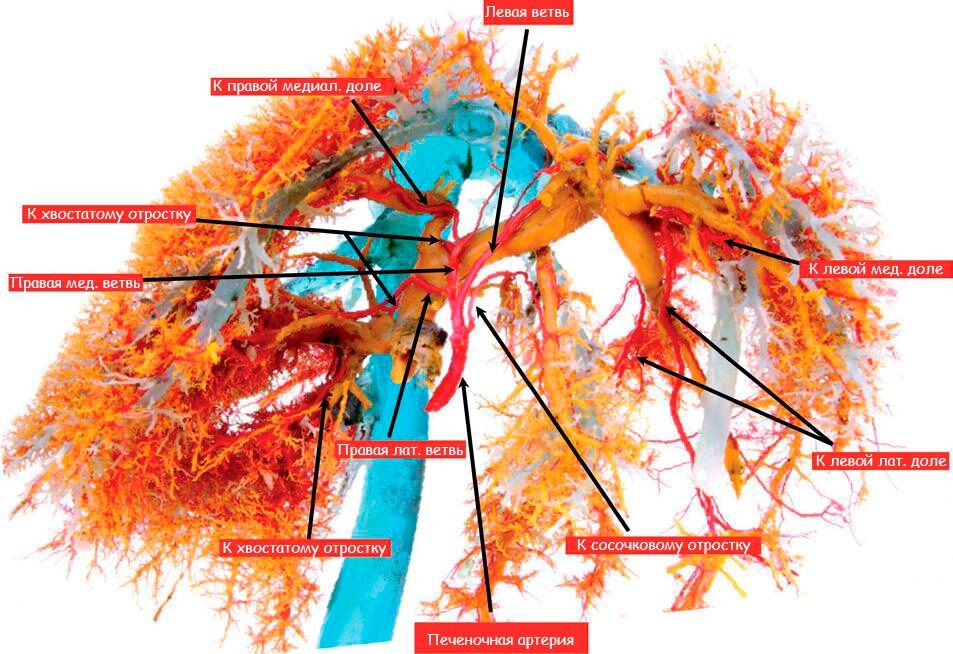
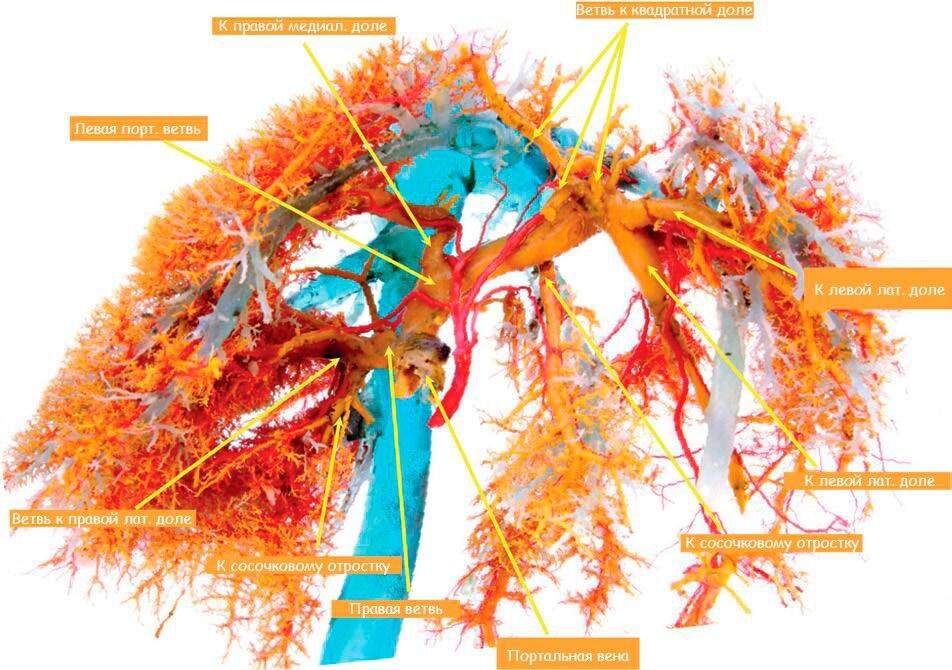
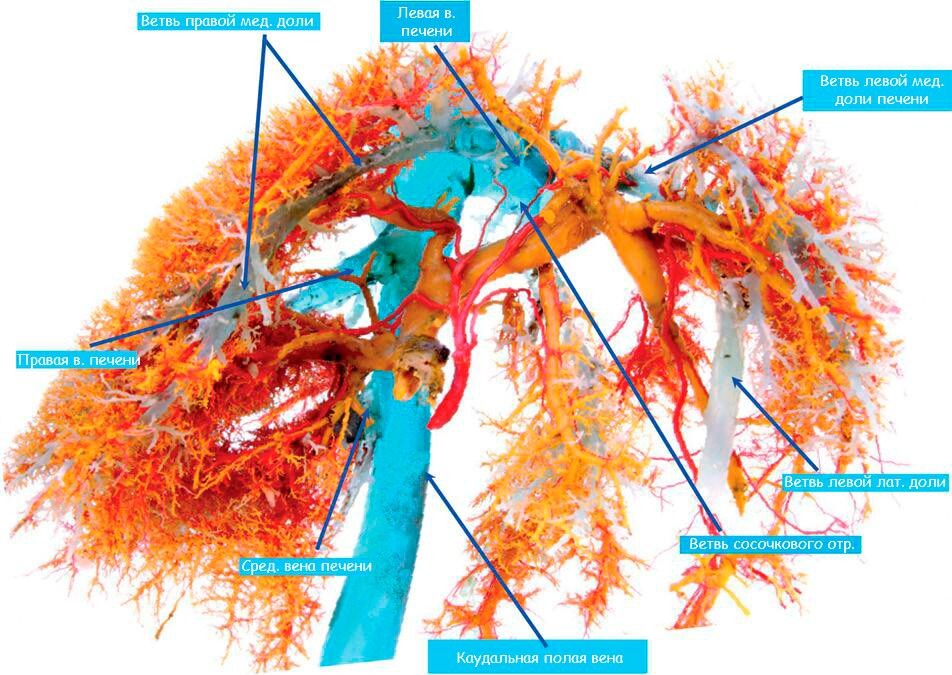
Сосудистый кровоток печени состоит из портальной вены, печеночной артерии и печеночных вен (1, 2). По портальной вене течет кровь из ЖКТ, поджелудочной железы и селезенки, через краниальную и каудальную мезентеральную вену, селезеночную вену, гастродуоденальную и левую желудочную вены. Примерно 80% печеночного кровотока обеспечивается портальной веной и 20% печеночной артерией (3, 4). Портальная вена, впадая в печень, подразделяется на правую и левую ветви (1, 5). Правая портальная вена кровоснабжает правые доли печени (правую латеральную и хвостатый отросток хвостатой доли печени). Левая портальная вена, больше и длиннее правой, кровоснабжает квадратную, левую медиальную и латеральную доли печени, сосочковый отросток хвостатой доли, а также правую медиальную долю печени, через центральную ветвь левой портальной вены. Портальные вены подразделяются в паренхиме печени на более мелкие ветви, образуя портальные триады (6). В синусах печени, венозная кровь из портальной системы, перемешивается с кровью из печеночной артерии, и поступает в вены печени, а далее в каудальную полую вену.
Рисунок 2. Анатомия печени у собаки (A); печеночной артерии (B); портальной вены (C); вен печени (D). Для увеличения изображений нажмите на них.
Классификация врожденных портосистемных шунтов у собак
Первые научные публикации о печеночных шунтах и портальных сосудистых аномалиях у мелких животных появились в 1970 годах (7-9). Портальные шунты приводят к накоплению токсинов в системном кровотоке, а также снижают поступление в печень необходимых для развития, питательных веществ из ЖКТ и поджелудочной железы, что является причиной гипоплазии печени и печеночной недостаточности. С тех пор, этиология, эпидемиология, диагностика и лечение ПСШ были хорошо изучены.
Врожденные портосистемные шунты бывают внепеченочные (наиболее распространенные) и внутрипеченочные. В исследованиях есть детальное описание морфологии различных внепеченочных портосистемных шунтов, благодаря применению компьютерной томографии, интраоперационной портографии и некропсии (10-15). Описано большое количество различных видов внепеченочных ПСШ у собак и кошек.
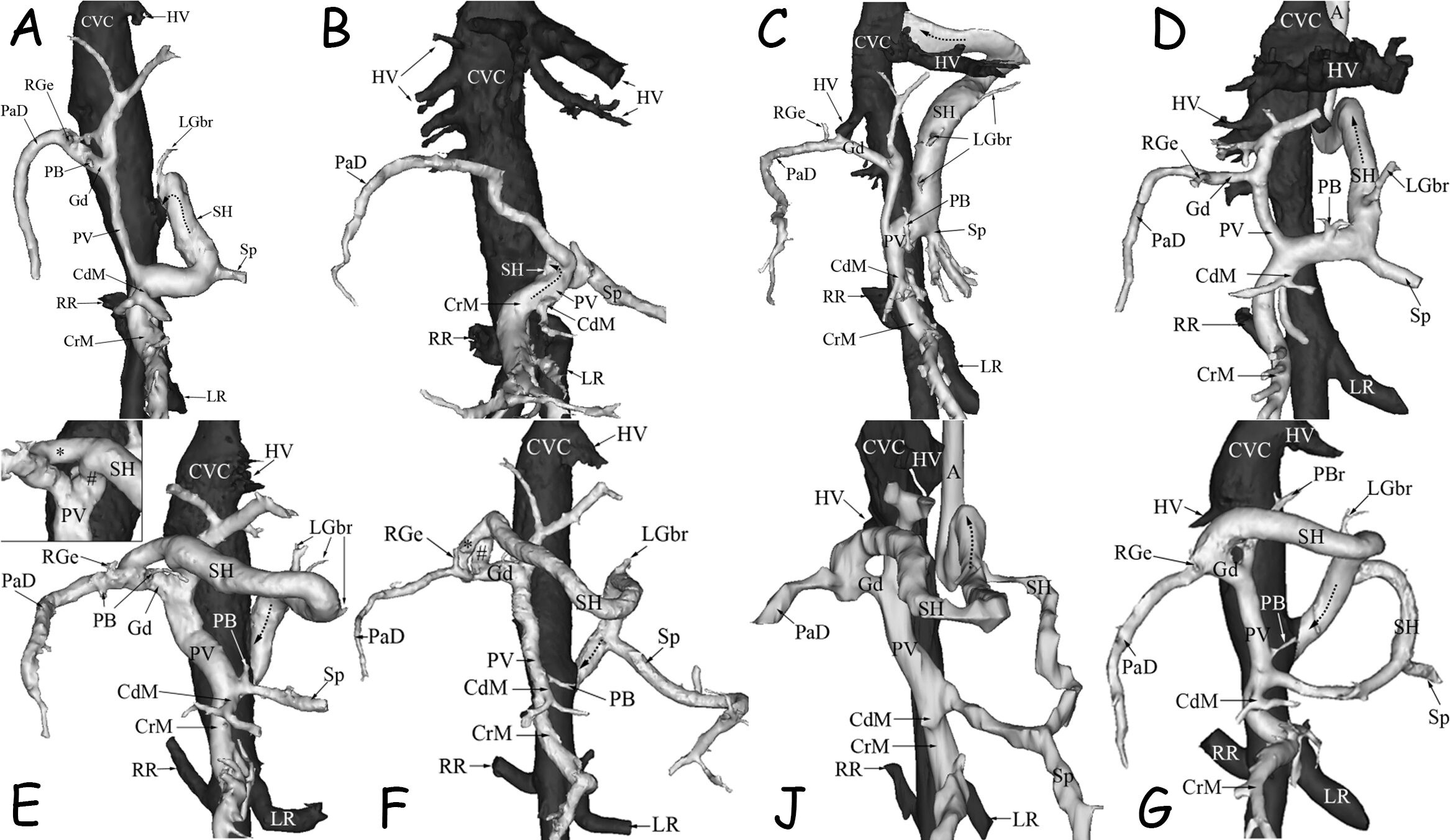
Наиболее часто у собак встречаются: спленофренальные, спленоазигональные, правые гастрокавальные, спленокавальные, правые гастрокавальные с каудальной петлей, правые гастрофренальные, левые гастрокавальные, левые гастроазигональные, колонокавальные и портокавальные шунты (таблица 1 и рисунок 3).
У кошек, наиболее часто встречаются следующие внепеченочные ПСШ (92%): сплено-кавальные, левые гастро-френальные и левые гастро-кавальные (16).
Рисунок 3. 3D-реконструкция КТ-ангиографии собак с внепеченочными ПСШ (вид с вентральной стороны): (A) Спленокавальный шунт; (B) Атипичный спленокавальный шунт; (C) Спленофренальный шунт; (D) Спленоазигональный шунт; (E) Правый гастрокавальный шунт; (F) Альтернативный вид правого гастрокавального шунта; (J) Правый гастроазигональный с каудальной петлей; (G) Правый шунт с каудальной петлей. Сокращения: SH — шунт, PV -портальная вена, Gd — гастродуоденальная вена, PaD — панкреодуоденальная вена, Sp -селезеночная вена, PB — ветвь поджелудочной железы, LGbr — ветвь к малой кривизне желудка, RGr — правая желудочно-сальниковая вена, CrM — краниальная брыжеечная вена, CdM — каудальная брыжеечная вена, HV — печеночная вена, RR — правая почечная вена, LR — левая почечная вена, A — непарная вена
Внутрипеченочные ПСШ связывают портальные вены с системным кровотоком, через печеночные вены или каудальную полую вену, из-за сохранения функционирующих венозных протоков или развиваются в процессе созревания плода, аномальных сосудов из печеночных синусов и портальных вен.
Внутрипеченочные ПСШ подразделяют на левые, правые и центральные (1-3). Они могут впадать в каудальную полую вену или любую печеночную вену. Морфология внутрипеченочных портосистемных шунтов хорошо описана в ряде исследований благодаря КТ-ангиографии (17-22). Существует классификация шунтов (таблица 1)(18, 19).
У собак, левосторонние внутрипеченочные ПСШ встречаются чаще всего (23, 24). Однако есть исследование, проведенное на 90 собаках с внутрипеченочными портосистемными шунтами, в котором правосторонние внутрипеченочные ПСШ являлись самым частым вариантом (25).
Левосторонние внутрипеченочные ПСШ, наиболее вероятно, являются следствием персистирования венозного протока плода, сосуда, отводящего кровь, поступающую в портальный синус из пупочной вены, в левую печёночную вену, во время внутриутробного развития (26, 27). Этот сосуд, в норме, должен перестать функционировать в первые 6 суток после рождения и полностью закрыться к 3 неделям. Закрытие венозного протока может происходить позже у некоторых пород собак. В исследовании на 22-ух ирландских волкодавах, венозный проток оставался функциональным у 65% щенков в возрасте 4 суток и у 23% в возрасте 6 суток, однако закрылся полностью у всех собак к 9 суткам жизни (28).
Внепеченочные ПСШ у кошек встречаются чаще. В одном исследовании 50 кошек с ПСШ, 40 из 50 шунтов были внутрипеченочными и только 10 внутрипеченочными (29). Большинство внутрипеченочных ПСШ у кошек были левосторонними из-за сохранения кровотока в венозном протоке (24, 30, 31).
Обычно, объем кровотока во внутрипеченочных шунтах больше чем во внепеченочных ПСШ.
В большинстве случаев врожденные ПСШ одиночные, однако редко могут встречаться множественные шунты (32).
Таблица 1. Анатомическая классификация врожденных портосистемных шунтов у собак
| Анатомическая классификация врожденных внепеченочных портосистемных шунтов у собак* | |
| Спленофренальный Спленоазигональный Правый гастрокавальный Спленокавальный Правый гастрокавальный с каудальной петлей Гастрофренальный Левый гастроазигональный Колонокавальный Портокавальный | |
| Анатомическая классификация врожденных внутрипеченочных шунтов у собак Традиционная анатомическая классификация врожденных внутрипеченочных шунтов у собак** | |
| Правосторонние Левосторонние Центральные | |
| Анатомическая подклассификация врожденных внутрипеченочных шунтов у собак** | |
| Тип шунта | Место впадения |
| Правосторонний | Правая латеральная вена печени Каудальная вена печени |
| Левосторонний | Левая вена печени Левая диафрагмальная вена |
| Центральный | Квадратная вена печени Центральная вена печени Правая дорсальная медиальная вена печени Вентральная часть каудальной полой вены |
| Множественный | Различные варианты |
| Анатомическая классификация врожденных внутрипеченочных шунтов у собак*** | |
| Левосторонние, правосторонние и центральные Врожденные аневризмальные портосистемные шунты Один и более шунтов в одной доле печени Множественные портосистемные шунты в нескольких долях печени | |
| *White et al. (2018) и Fukushima et al. (2014)(14, 15) **Plested et al. (2020)(19) ***Bertolini et al. (2019)(18) | |
Патофизиология портосистемных шунтов у собак
Большинство клинический симптомов у собак с портосистемными шунтами связаны с печеночной энцефалопатией (ПЭ). ПЭ — неврологическое нарушение, вызванное потерей функции печени на >70% (печеночная недостаточность) или портосистемными сосудистыми аномалиями (33, 34).
Есть адаптированная для ветеринарии классификация печеночной энцефалопатии (35):
- Тип А: острая печеночная недостаточность без предшествующего заболевания;
- Тип B: портосистемный шунт без потери функции печени;
- Тип C: цирроз, портальная гипертензия или вторичные шунты.
В ветеринарии чаще всего встречается тип B (36). Клинические симптомы ПЭ варьируются от слабовыраженных и неспецифичных, до судорог и комы. Более того, хроническая ПЭ (типы B и C) может проявляться только периодически.
Существует модифицированная для ветеринарии классификация выраженности клинических симптомов ПЭ (33, 34, 37):
- 0 степень — нет симптомов;
- I степень — небольшое снижение активности, апатичность;
- II степень — выраженная апатия, небольшая атаксия;
- III степень — гиперсаливация, выраженная атаксия, опускание головы, слепота, хождение по кругу;
- IV степень — судороги, ступор или кома.
Патогенез печеночной энцефалопатии комплексный и до конца не изученный. Печень играет центральную роль в детоксикации и нейтрализует множества токсинов, абсорбирующихся в ЖКТ или образующихся в процессе нормального метаболизма.
Большинство токсинов попадает в печень через систему портальных вен, далее они проходят через печеночные синусы, где захватываются и нейтрализуются гепатоцитами. Если функция печени нарушена или есть шунтирующий печень сосуд, печень не выполняет функцию детоксикации, что приводит к накоплению токсинов в системном кровотоке и поражению центральной нервной системы.
Хотя роль аммиака в развитии ПЭ хорошо изучена, существует много других токсинов и факторов, влияющих на развитие ПЭ: оксидативный стресс, эндогенные бензодиазепиноподобные лиганды, отек астроцитов, подобные гамма-аминобутановой кислоте молекулы, аномальная нейротрансмиссия гистамина и серотонина, эндогенные опиаты, нейростероиды, воспалительные цитокины и потенциальная токсичность марганца (38).
Несколько медицинских исследований, выявили высокую роль влияния аммиака и отека мозга в развитии печеночной энцефалопатии (39, 40). Отек мозга частично обусловлен захватом аммиака астроцитами, в них аммиак комбинируется с глутаматом для продукции глютамина, который вызывает отек клеток.
Однако уровень аммиака не коррелирует с выраженностью печеночной энцефалопатии (41). Поэтому аммиак не может полностью объяснить патофизиологию развития ПЭ.
Инфекция и воспаление также играют важную роль в развитии ПЭ (44-46). В нескольких исследованиях, печеночная энцефалопатия развивалась при повышении уровня аммиака и присутствия медиаторов воспаления в крови (42, 43).
Кроме того, у собак и кошек было зарегистрировано несколько факторов, которые могут потенциально спровоцировать ПЭ (33, 34, 45): кровотечение в ЖКТ; переливание хранящейся крови; высокобелковая диета; констипация; гипокалиемия; гипонатриемия; метаболический алкалоз; обезвоживание; инфекция; сепсис; различные медикаменты (мочегонные, опиаты) и несоблюдение лечебных рекомендаций.
Поэтому очень важно идентифицировать и устранять любые провоцирующие ПЭ факторы у собак и кошек с ПСШ (например, назначение низкобелковой диеты, антибиотиков, слабительных).
Из-за наличия шунта, кровь обходит печень, что нарушает ее нормальное развитие. Портосистемные шунты приводят к гипоплазии печени и нарушению ее функции (47). Нарушение функции печени в анализах крови, проявляется в виде гипоальбуминемии и гипогликемии, так как печень является основным источником альбумина и играет важную роль в поддержании гомеостаза глюкозы.
Печень играет важную роль в системе свертывания крови, так как продуцирует и элиминирует большинство факторов, которые регулируют прокоагуляцию, антикоагуляцию и фибринолиз. Несколько исследований изучали влияние наличия ПСШ на коагуляцию и выявили тенденцию к кровоточивости и тромбообразованию, однако спонтанные кровотечения и тромбы встречаются очень редко в клинической практике (48, 49).
Эпидемиология собак с портосистемными шунтами
Врожденные портосистемные шунты могут встречаться у любых собак, однако чаще всего их диагностируют у чистокровных пород (50, 51).
Внепеченочные ПСШ обычно встречаются у мелких пород собак, таких как йоркширский терьер, мальтезе, мопс и миниатюрный шнауцер (1, 52, 53).
Внутрипеченочные шунты диагностируют чаще у крупных пород собак, например лабрадоров и золотистых ретриверов, немецких овчарок, волкодавов и доберманов (54, 55).
Реже портосистемные шунты встречаются у кошек, к наиболее предрасположенным породам относят: персидскую, сиамскую, бирманскую и гималайскую (3, 30, 56-60).
Часто встречаемые породы животных с шунтами, могут варьироваться в зависимости от страны исследования из-за генетических различий в популяции или влияния факторов внешней среды (53, 58).
Непредрасположенные к врожденным портосистемным шунтам породы собак, скорее всего будут иметь нетипичную морфологию шунта.
Левосторонние внутрипеченочные ПСШ, из-за функционирования венозного протока, считаются наследственными у Ирландских волкодавов (61-63).
Большинство собак и кошек с врожденными ПСШ диагностируют в возрасте 1-2 лет, однако в ряде случаев, шунт диагностируют в более позднем возрасте (5-10 лет)(30, 56, 60, 64, 65).
Чаще всего в клинической практике встречаются внепеченочные портосистемные шунты. На долю внутрипеченочных ПСШ приходится менее 10%. Такая статистика связана с высокой популярностью мелких пород собак.
Клинические симптомы (признаки) портосистемных шунтов у собак
Симптомы у собак с шунтами могут нарастать и угасать или возникать периодически. Чаще всего нарушается работа центральной нервной системы (ЦНС), желудочно-кишечного тракта и мочевыделительной системы.
Нарушение функции ЦНС связано с печеночной энцефалопатией (видео 1) и, вероятно, гипогликемией. В одном исследовании 68% собак, которым проводили хирургическое устранение ПСШ, имели неврологические отклонения (67).
Классические симптомы ПЭ включают в себя: судороги, нарушение поведения, депрессию, летаргию, временную слепоту, атаксию, наклон головы, дезориентацию, хождение по кругу, кому, агрессивное или пугливое поведение (1, 51, 65).
Выраженность симптомов печеночной энцефалопатии варьируется: от незначительных – до угрожающих жизни состояний. В некоторых случаях (30-50% собак) наиболее выраженные симптомы наблюдаются после кормления (мясом или другой белковой пищей) (65, 66).
Большинство кошек (более 90%) с ПСШ поступают с неврологическими симптомами ПЭ (31).
ЖКТ симптомы, связанные с ПСШ, обычно слабовыраженные и неспецифичные: периодическая рвота, диарея, анорексия, потеря веса и мелена (51, 68).
Значимое ЖКТ кровотечение встречается у собак с внутрипеченочными шунтами и является неблагоприятным прогностическим фактором (54).
Гипергастринемия и повышенная продукция соляной кислоты в желудке, связаны со сниженной утилизацией гастрина или его повышенной выработкой из-за желчных кислот, аномального кровотока и сниженной выработки слизи и являются наиболее вероятной причиной кровотечения в ЖКТ (3). Проведение эндоскопии верхних отделов желудочно-кишечного тракта у таких животных, выявляет наличие очагов с кровотечением, назначение ингибиторов протонной помпы (до и после операции), снижает частоту осложнений (54, 69).
Птиализм (слюнотечение) – частый клинический симптом у кошек с врожденными портосистемными шунтами (3, 70, 71).
Гематурия, дизурия, странгурия, полиурия, поллакиурия и обструкция мочеиспускательного канала – основные клинические симптомы поражения мочевыделительной системы у животных с врожденными портосистемными шунтами (65, 71-77).
Сниженная продукция мочевины, повышенная экскреция аммиака и снижение метаболизма мочевой кислоты, приводят к формированию кристаллов мочекислого аммония и камней в моче, что способствует развитию бактериальной инфекции мочевыделительной системы у собак и кошек с ПСШ (65).
Полидипсия/полиурия – распространенный симптом у многих животных с ПСШ, который связан с нарушением нейроэндокринной функции (51, 78).
К другим симптомам у собак и кошек с врожденными ПСШ относят: отставание в росте, сниженную массу тела, лихорадку и эпизодическую слабость (56, 71, 75, 77, 79).
Портальная гипертензия (ПГ) – редкая клиническая находка у животных с ПСШ, асциты как правило не развиваются, за исключением случаев с гипоальбуминемией на фоне кровотечения в ЖКТ, печеночной недостаточностью или низкого потребления белка с пищей.
Медный цвет радужной оболочки отмечается у некоторых кошек с ПСШ (рисунок 4), однако причины этого непонятны (56, 70, 71, 77).
Выраженность клинических симптомов также зависит от морфологии портосистемного шунта. Портоазигональные и портофренальные внепеченочные ПСШ, обычно связаны с менее выраженными клиническими симптомами и могут быть диагностированы уже во взрослом возрасте (80). Возможно это связано с частичной компрессией аномального сосуда (шунта) диафрагмой во время дыхания или пищевыми массами в желудке (80, 81).
По наблюдениям автора, основными причинами обращения к врачу, собак с печеночными шунтами являются: отставание в росте, хронические проблемы с ЖКТ и неврологические симптомы. Гораздо реже встречаются симптомы нарушения работы мочевыделительной системы.

Рисунок 4. Медный цвет радужной оболочки у кота с шунтом.
Видео 1. Собака с шунтом и неврологическими симптомами (печеночная энцефалопатия): бесцельное блуждание, опускание головы.
Диагностика портосистемных шунтов у собак
Предварительный диагноз портосистемного шунта у собак ставят на основании данных анамнеза, клинического осмотра и анализов крови. Для постановки окончательного диагноза требуется проведение визуальных методов диагностики: ультразвукового исследования, КТ-ангиографии или портографии.
Гематологические исследования (общий анализ крови)
У животных с ПСШ отмечают: нерегенераторную, микроцитарную и нормохромную анемию (70, 77, 82, 83), лейкоцитоз.
Микроцитарная анемия чаще встречается у собак и проходит после устранения шунта, точный механизм ее развития неизвестен. В исследованиях микроцитарную анемию связывают с дефектом метаболизма железа, а не дефицитом железа (83, 84). Однако, в другом исследовании, не выявили взаимосвязь между дисрегуляцией продукции гепсидина и анемии у собак с портосистемными шунтами (85).
Лейкоцитоз может быть связан с недостаточной утилизацией бактерий или эндотоксинов из портальной системы, что приводит к бактериемии или эндотоксемии и является плохим прогностическим фактором (51, 65, 86, 87).
Система свертывания крови (коагулограмма)
Печень играет ключевую роль в выработки факторов свертывания крови (88). Больная часть этих факторов выводится также печенью. Патологии печени могут приводит к нарушению коагуляции.
Несколько исследований оценивало функцию системы свертывания крови у собак с врожденными портосистемными шунтами (48, 49, 89, 90). В ходе исследования выявили изменения в сывороточной концентрации белков, участвующих в прокоагуляции и антикоагуляции.
Удлиненное протромбиновое время (ПТВ) и активированное частичное тромбопластиновое время (АЧТВ), сниженное количество тромбоцитов и дефицит ряда факторов свертывания (II, V, VII, и IX), могут приводить собак с ПСШ в состоянии гипокоагуляции (49, 89-91).
Хотя сниженное антитромбиновое время и активность протеина C, в сочетании с повышенной активностью фактора VIII и фон Виллебранда, могут наоборот приводить животных в состояние гиперкоагуляции (49, 89). Более того, в исследовании тромбоэластограмм у собак с ПСШ, выявлена тенденция к гиперкоагуляции, однако ни одно животное не имело признаков кровоточивости или тромбоза (48).
Интересной находкой является то, что собаки с ПСШ в состоянии гиперкоагуляции, имеют клинические признаки печеночной энцефалопатии в 40 раз чаще (48).
Тем не менее, несмотря на нарушения в системе свертывания крови у собак с портосистемными шунтами, тромбозы портальных вен и спонтанные кровотечения встречаются крайне редко (49, 87, 92).
Информации по кошкам мало. В одном исследовании выявили удлинение ПТВ и АЧТВ у большинства кошек (87,5% и 68,8% соответственно) с ПСШ (93). У кошек, также как и у собак, данные отклонения не приводили к спонтанным кровотечениям или послеоперационным осложнениям, связанным с кровотечением.
Биохимический анализ крови (АСТ, АЛТ, ЩФ, глюкоза, мочевина)
У собак и кошек с ПСШ отклонения по биохимическому анализу крови варьируются.
Часто отмечается повышенная активность печеночных ферментов (щелочная фосфатаза, аланинаминотрансфераза, аспартатаминотрасфераза).
Гипоальбуминемия, гипохолестеринемия, гипопротеинемия и сниженная концентрация мочевины также встречаются.
Гипогликемия может отмечаться из-за сниженного содержания в печени гликогена и функции глюконеогенеза.
Низкая концентрация креатинина и мочевины может развиваться из-за ускоренной скорости клубочковой фильтрации (70, 77, 78).
Анализ мочи (плотность мочи, биураты аммония)
Распространенные отклонения в анализе мочи у собак с портосистемными шунтами: сниженная плотность мочи и наличие кристаллов биурата аммония. Биураты аммония встречаются у >57% собак и 42% кошек с врожденными ПСШ (70, 72-74, 77, 94-96).
Функциональные тесты печени (желчные кислоты, аммиак)
Из-за неспецифичного и разнообразного клинического проявления печеночных шунтов у собак, для постановки диагноза используют функциональные тесты печени.
Измерение концентрации желчных кислот (ЖК), является самым распространенным исследованием функции печени, у собак с портосистемными шунтами.
Повышенная концентрация желчных кислот связана с попаданием в системный кровоток реабсорбированных в кишечнике ЖК через шунтирующий сосуд. Для максимальной чувствительности теста (100%), концентрацию ЖК измеряют дважды — после 12-ти часового голодания и приема пищи (97-101). Для оценки концентрации ЖК после приема пищи, животным дают богатую белками и жирами еду, с целью стимуляции сокращения желчного пузыря.
Проблема в том, что повышенная концентрация желчных кислот встречается при различных патологиях, например внутри- или внепеченочном холестазе (102-104). Клинически здоровые собаки породы
Мальтезе могут иметь повышенную концентрацию ЖК без патологий печени (105).
Необходимо отменить прием урсодезоксихолевой кислоты, как минимум за 72 часа, до определения концентрации ЖК, так как длительный прием урсодезоксихолевой кислоты приводит к повышенной концентрации ЖК у здоровых собак (106).
Определение концентрации аммиака в плазме крови еще один функциональный тест печени, используемый в диагностике ПСШ у собак и кошек.
Аммиак синтезируется из пищевого белка и вторично, за счет слизистой ЖКТ и почек, а также при кровотечении в ЖКТ. Аммиак в норме поступает в печень по портальным венам, где конвертируется в мочевину в гепатоцитах.
Повышенная концентрация аммиака обычно отмечается у собак и кошек с портосистемными шунтами, однако возможно получение ложно-отрицательных результатов (70, 75, 77, 101).
Другая возможная причина повышенной концентрации аммиака — печеночная недостаточность и сниженная функция энзимов в цикле мочевины (107, 108).
Чувствительность определения аммиака с целью диагностики ПСШ у собак варьируется и составляет 81-100% (65, 96, 109, 110).
Еще одна сложность заключается в определении возможности вывода аммиака в организме. Для этого проводят контрольное определение аммиака в крови, через 6 часов после кормления и проводят тесты на переносимость мочевины (109, 107, 111, 112).
Транзиторная гипераммониемия из-за дефицита энзимов в цикле мочевины задокументирована у молодых Ирландских волкодавов без портосистемных шунтов (108, 113).
В клинической практике, обычно определяют уровень аммиака и желчных кислот вместе. Реже используют стимулирующие тесты с кормлением. Также учитывают данные общего и биохимического анализов крови.
Протеин C относится к К-зависимым белкам, которые активируются тромбином (114). Протеин C синтезируется печенью и играет важную роль в поддержании баланса гемостаза, защите от тромбоэмболизма и регуляции воспаления и апоптоза (115).
Протеин C применяется, как биомаркер функции печени и гепато-портальной перфузии. У здоровых собак, активность протеина C >70%, а у животных с заболеванием печени отмечается его сниженная концентрация (89, 91, 116). В недавнем исследовании, получены данные о сниженной активности протеина С у собак с врожденными портосистемными шунтами, а после эмболизации шунта отмечалось повышение активности белка в большинстве случаев (116).
В другом исследовании сниженная активность протеина C отмечалась в 98% случаев собак с шунтами, по сравнению с 30% случаев животных с гипоплазией портальной вены без ПСШ (89). Определение активности протеина C можно использовать для дифференциации животных с портосистемными шунтами и гипоплазией портальной вены.
Также стоит помнить о сниженной активности протеина C при других патологиях: печеночной недостаточности, сепсисе и застойной сердечной недостаточности (117-119).
Патоморфология (гистология) печени
У животных с врожденными портосистемными шунтами гистологические изменения связаны со сниженным портальным кровотоком.
Часто обнаруживают: гипоплазию портальных вен, пролиферацию или дупликацию артериол, гепатоклеточную атрофию, пролиферацию желчных протоков, липидоз и формирование липогранулем (47, 120-124).
Также встречается: гипертрофия гладких мышц, увеличение лимфатических протоков вокруг центральных вен, гипертрофию клеток Купфера и Ито, гемосидероз, фиброз или некроз клеток печени, а также воспаление (25, 57, 120-123).
Изменения могут варьироваться в различных долях печени (47).
Фиброз, гиперплазия желчных протоков и некроз, являются негативным фактором (121, 125). Устранение шунта может не привести к улучшению гистологической характеристики печени (120, 124).
Визуальные методы диагностики (узи, рентген, компьютерная томография)
Нативная рентгенография обладает небольшой диагностической ценностью у собак с портосистемными шунтами. Обычные находки: микрогепатия (рисунок 5) и реномегалия (126).
Кристаллы и камни из аммония обычно рентгенопрозрачные, однако их иногда можно увидеть на рентгеновском снимке, если они содержат в себе соли кальция.
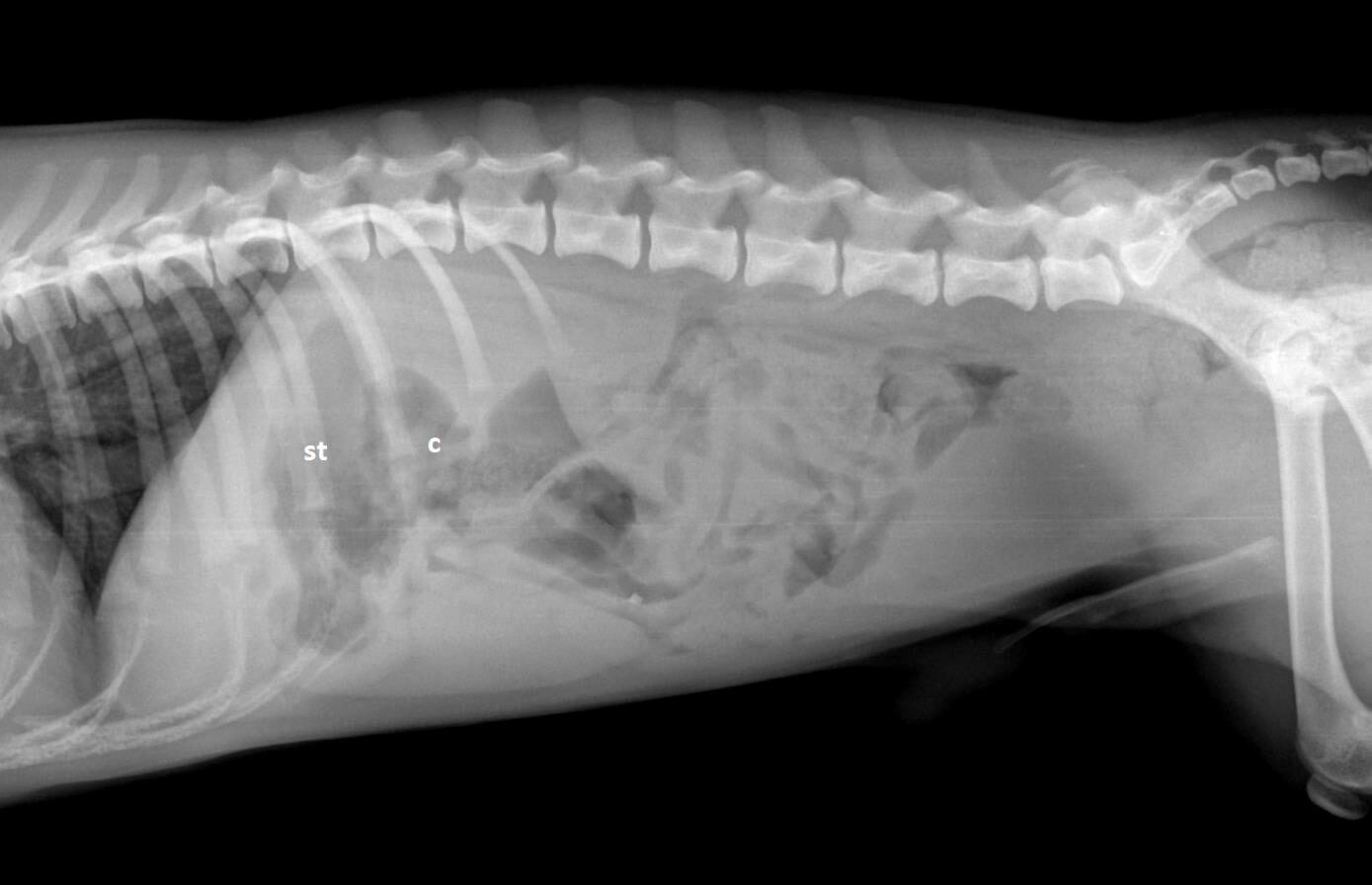
Рисунок 5. Рентгенография брюшной полости собаки с портосистемным шунтом. На снимки можно увидеть признаки уменьшения в размерах печени (краниальное смещение желудка (st) и ободочной кишки (c)).
Ультразвуковое исследование (УЗИ) — самый доступный метод визуализации шунтов у собак и кошек (56, 76, 126-128). Основные плюсы: невысокая цена, быстрая скорость получения результатов и нет необходимости в анестезии. Ключевым минусом является зависимость от опыта оператора.
Частые находки у собак с врожденными внепеченочными портосистемными шунтами: микрогепатия, сниженная визуализация печеночных и портальных вен и их ветвей, наличие аномальных сосудов, увеличение почек в размерах и сниженное соотношение портальная вена/аорта (30, 56, 60, 76, 128).
В ряде случаев можно обнаружить турбулентный ток крови в месте впадения шунта в системный кровоток.
Для постановки диагноза ПСШ необходимо определить его начало и впадение (36, 129). Существуют протоколы системной оценки портальной вены у собак (129).
Чувствительность и специфичность УЗИ с целю определения ПСШ, составляет 74-95% и 67-100% соответственно, однако стоит помнить, что невозможность определения шунта во время УЗИ не исключает его фактическое наличие (56, 127, 128, 130).
Внутрипеченочные шунты и их морфологию можно также определить при помощи УЗИ (рисунок 6 и 7), чувствительность и специфичность достигают 100% (76, 128, 130).
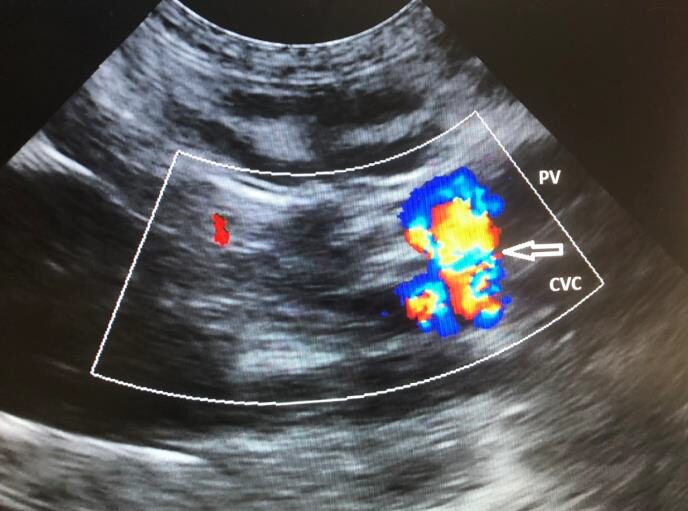
Рисунок 6. Ультразвуковое цветное допплеровское изображение краниальной части брюшной полости собаки, в сагиттальной плоскости, показывает наличие внепеченочной коммуникации (стрелка) воротной вены (PV) с каудальной полой веной (CVC). Внутри шунтирующего сосуда имеется турбулентный кровоток, на что указывает мозаичный паттерн цветов.
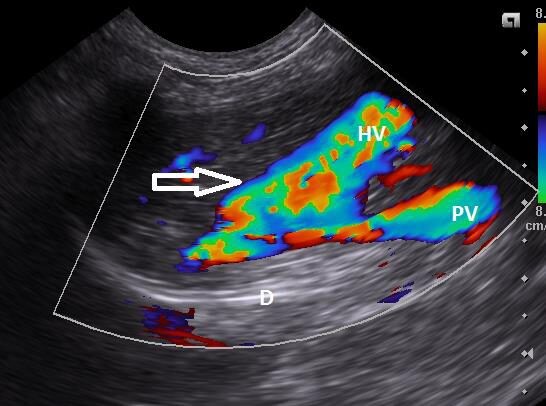
Рисунок 7. Ультразвуковое цветное допплеровское изображение правой доли печени в косой проекции, у молодой собаки с внутрипеченочным врожденным портокавальным шунтом. Имеется внутрипеченочное соединение (стрелка) ветви воротной вены (PV) с аномальным расширенным печеночным сосудом (HV). D — диафрагма.
Мезентеральная портография (рисунок 8) является еще одним методом диагностики врожденных портосистемных шунтов, который сейчас редко используется из-за наличия менее инвазивных методов исследования (УЗИ, КТ).
Для проведения портографии требуется общая анестезия и лапаротомия, чтобы установить катетер в тощекишечную вену. Для контрастирования используют болюсное введение контраста в дозе 2-4 мл/кг (131).
Портография имеет чувствительность 85-100%. Катетер в вене можно также использовать для измерения портального давления в ходе операции.
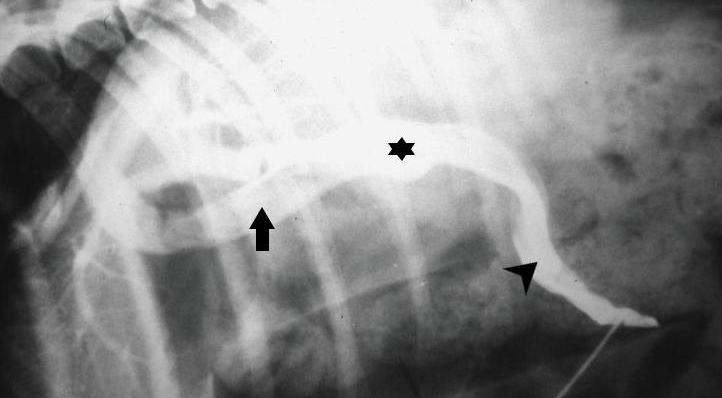
Рисунок 8. Интраоперационная портография собаки с портокавальным шунтом, который отмечен на рентгенограмме звездочкой. Стрелка — каудальная полая вена, наконечник стрелки — портальная вена.
КТ-ангиография (рисунок 9) — быстрый, точной и неинвазивный метод диагностики портосистемных шунтов у собак.
Исследование позволяет получить детальную информацию по морфологии шунта и кровоснабжении печени для планирования операции (15, 20, 22, 132-135).
КТ-ангиография является во многом методом выбора диагностики ПСШ у животных.
В одном исследовании чувствительность и специфичность исследования составила 96% и 89% соответственно, что лучше по сравнению с УЗИ (68% и 84%) (132). Специальные программы позволяют создавать 3D реконструкции томографии (рисунок 10).
По мнению автора, КТ-ангиография является «золотым» стандартом в диагностике ПСШ у собак.
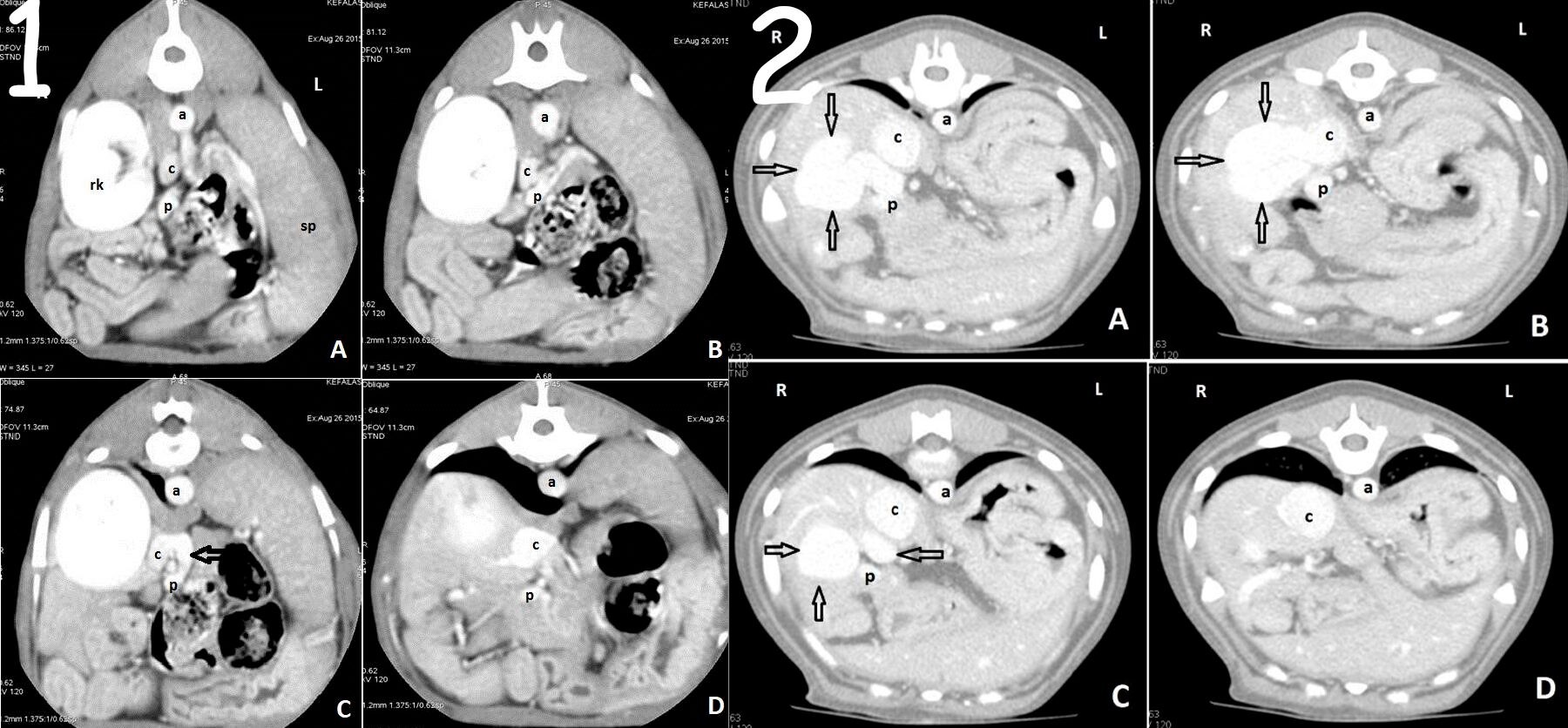
Рисунок 9. (1A-D) Аксиальные снимки собаки с внепеченочным ПСШ в портальную фазу. Шунт (черная стрелка), начинается от портальной вены (p) и впадает в каудальную полую вену (с). a — аорта, rk — правая почка, sp — селезенка. (2A-D) Аксиальные снимки собаки с внутрипеченочным шунтом в портальную фазу. Большой сосуд (стрелки) начинается от портальной вены с правой стороны (p) и в правых долях печени впадает в каудальную полую вену (с). a — аорта.
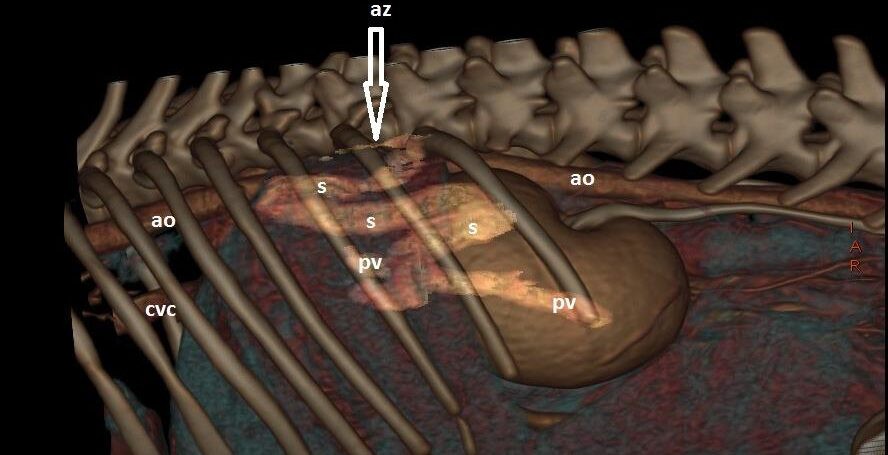
Рисунок 10. 3D реконструкция КТ-ангиографии собаки с портоазигональным шунтом (s). ao — аорта, az — непарная вена, cvc — каудальная полая вена, pv — портальная вена.
Магнитно-резонансная томография (МРТ) позволяет получить хорошую визуализацию врожденных портосистемных шунтов у собак и спланировать хирургическое вмешательство.
В нескольких исследования МРТ оценивали для выявления ПСШ (136-138). В одном исследовании получена чувствительность и специфичность 80% и 100% соответственно (137).
Однако компьютерная томография проще, быстрее и дешевле МРТ исследования.
Дифференциальная диагностика портосистемных шунтов у собак
Во многих случаях, данные анамнеза, клинического остра и лабораторных исследований, очень характерны для собак с портосистемными шунтами.
Однако, у собак и кошек, с подозрением на наличие ПСШ, схожие клинические симптомы, могут быть вызваны различными патологиями: гельминтами, гипогликемией карликовых пород собак, идиопатической эпилепсией, гидроцефалией, гипоадренокортицизмом, энтеропатией с потерей белка и другими.
В случаях с повышенной концентрацией желчных кислот и аммиака в крови, портосистемные шунты нужно дифференцировать от первичной гипоплазии портальной вены с или без гипертензии и артериовенозной мальформации.
Собаки с некоторыми заболеваниями печени, такими как хронический гепатит, долевой гепатит, цирроз и даже острая печеночная недостаточность на фоне лептоспироза, могут иметь клинические признаки, схожие с ПСШ, однако, как правило это животные старшего возраста с билирубинемией.
Гипоплазия портальной вены (микрососудистая дисплазия печени или МПВ) без портальной гипертензии проявляет себя схожим с внепеченочными портосистемными шунтами образом (47, 104, 139, 140).
Гипоплазия портальной вены без гипертензии характеризуется сниженным количеством внутрипеченочных ветвей портальной вены, из-за чего венозная кровь не поступает к гепатоцитам.
Может встречаться сочетание патологий МДП и ПСШ (140).
Микрососудистая дисплазия печени чаще встречается у карликовых и мелких пород: Керн-терьеров, Йоркширский терьеров, Мальтезе, тибетских спаниелей, миниатюрных шнауцеров, Ши-тцу и той-пуделей (139).
Возраст обращения животных с МДП обычно старше по сравнению с ПСШ, из-за менее выраженных клинических симптомов или их отсутствия (например, когда повышенная концентрация желчных кислот является случайной находкой).
Большинство собак с гипоплазией портальной вены без портальной гипертензии можно разделить на две группы: с наличием клинических симптомов и асимптоматичных.
У некоторых из них может отмечаться непереносимость ряда медикаментов, которые метаболизируются или экскретируются печенью.
Описаны случаи наличия симптомов нарушения работы ЦНС, ЖКТ и мочевыделительной системы у собак с микрососудистой дисплазией без портальной гипертензии (104, 139).
В клинической практике, большинство собак с МДП без портальной гипертензии не проявляют клинических симптомов.
Лечение, осложнения и прогноз собак с портосистемными шунтами
Из-за большого объема информации, лечение (операция, медикаменты), осложнения и прогноз, связанные с портосистемными шунтами у собак, будут рассмотрены в ЭТОЙ статье.
Выводы и заключение
- Данные анамнеза, клинического осмотра и лабораторных исследований, позволяют заподозрить наличие портосистемного шунта у собаки.
- Клинические симптомы неспецифичные и, как правило, связаны с нарушением функции ЦНС, ЖКТ или мочевыделительной системы. Выраженность симптомов варьируется, они могут быть постоянными или периодическими, усиливаться или уменьшаться с течением времени.
- Самыми надежными способами постановки диагноза являются визуальные (УЗИ, КТ) методы или функциональные тесты (желчные кислоты, мочевина).
- Для планирования оперативного вмешательства и постановки точного диагноза, как правило проводят КТ-ангиографию.
Список используемой литературы
Полные версии статьей можно найти на сайте — PubMed.
Konstantinidis AO, Patsikas MN, Papazoglou LG, Adamama-Moraitou KK. Congenital Portosystemic Shunts in Dogs and Cats: Classification, Pathophysiology, Clinical Presentation and Diagnosis. Vet Sci. 2023 Feb 17;10(2):160
- Tobias, K. Portosystemic Shunts and Other Hepatic Vascular Anomalies. In Textbook of Small Animal Surgery; Slatter, D., Ed.; Saunders Elsevier: Philadelphia, PA, USA, 2003; pp. 727–751.
- Berent, A.; Tobias, K. Hepatic Vascular Anomalies. In Veterinary Surgery: Small Animal; Johnston, S., Tobias, K., Eds.; Elsevier: St. Louis, MO, USA, 2018; pp. 1852–1885.
- Weisse, C.; Berent, A. Hepatic Vascular Anomalies. In Textbook of Veterinary Internal Medicine; Ettinger, S., Feldman, E., Cote, E., Eds.; Saunders: St Louis, MO, USA, 2017; pp. 1639–1658.
- Markowitz, J.; Rappaport, A.; Scott, A.C. The Function of the Hepatic Artery in the Dog. Am. J. Dig. Dis. 1949, 16, 344–348.
- Evans, H.E.; de Lahunta, A. The Digestive Apparatus and Abdomen. In Miller’s Anatomy of the Dog; Evans, H.E., de Lahunta, A., Eds.; WB Saunders: St. Louis, MO, USA, 2013; pp. 281–338.
- Washabau, R.J. Liver. In Canine and Feline Gastroenterology;Washabau, R.J., Day, M.J., Eds.; Elsevier: St. Louis, MO, USA, 2013; pp. 849–957.
- Hickman, J.; Edwards, J.E.; Mann, F. Venous Anomalies in a Dog; Absence of the Portal Vein; Continuity of Lower Part of Inferior Vena Cava with the Azygos Vein. Anat. Rec. 1949, 104, 137–146.
- Audell, L.; Jönsson, L.; Lannek, B. Congenital Porta-Caval Shunts in the Dog; a Description of Three Cases. Zentralbl. Veterinarmed. A 1974, 21, 797–805.
- Ewing, G.; Suter, P.; Bailey, C. Hepatic Insufficiency Associated with Congenital Anomalies of the Portal Vein in Dogs. J. Am. Anim. Hosp. Assoc. 1974, 10, 463–476.
- White, R.N.; Parry, A.T. Morphology of Splenocaval Congenital Portosystemic Shunts in Dogs and Cats. J. Small Anim. Pract. 2016, 57, 28–32.
- White, R.N.; Parry, A.T. Morphology of Congenital Portosystemic Shunts Involving the Right Gastric Vein in Dogs. J. Small Anim. Pract. 2015, 56, 430–440.
- White, R.N.; Parry, A.T. Morphology of Congenital Portosystemic Shunts Involving the Left Colic Vein in Dogs and Cats. J. Small Anim. Pract. 2016, 57, 247–254.
- White, R.N.; Parry, A.T. Morphology of Congenital Portosystemic Shunts Emanating from the Left Gastric Vein in Dogs and Cats. J. Small Anim. Pract. 2013, 54, 459–467.
- White, R.N.; Parry, A.T.; Shales, C. Implications of Shunt Morphology for the Surgical Management of Extrahepatic Portosystemic Shunts. Aust. Vet. J. 2018, 96, 433–441.
- Fukushima, K.; Kanemoto, H.; Ohno, K.; Takahashi, M.; Fujiwara, R.; Nishimura, R.; Tsujimoto, H. Computed Tomographic Morphology and Clinical Features of Extrahepatic Portosystemic Shunts in 172 Dogs in Japan. Vet. J. 2014, 199, 376–381.
- White, R.N.; Shales, C.; Parry, A.T. New Perspectives on the Development of Extrahepatic Portosystemic Shunts. J. Small Anim. Pract. 2017, 58, 669–677.
- Seller, S.;Weisse, C.; Fischetti, A.J. Intrahepatic Venous Collaterals in Dogs with Congenital Intrahepatic Portosystemic Shunts Are Associated with Focal Shunt or Hepatic Vein Narrowing. Vet. Radiol. Ultrasound 2022, 63, 64–72.
- Bertolini, G. Anomalies of the Portal Venous System in Dogs and Cats as Seen on Multidetector-Row Computed Tomography: An Overview and Systematization Proposal. Vet. Sci. 2019, 6, 10.
- Plested, M.J.; Zwingenberger, A.L.; Brockman, D.J.; Hecht, S.; Secrest, S.; Culp,W.T.N.; Drees, R. Canine Intrahepatic Portosystemic Shunt Insertion into the Systemic Circulation Is Commonly through Primary Hepatic Veins as Assessed with CT Angiography. Vet. Radiol. Ultrasound 2020, 61, 519–530.
- Frank, P.; Mahaffey, M.; Egger, C.; Cornell, K.K. Helical Computed Tomographic Portography in Ten Normal Dogs and Ten Dogs with a Portosystemic Shunt. Vet. Radiol. Ultrasound 2003, 44, 392–400.
- Bertolini, G.; Diana, A.; Cipone, M.; Drigo, M.; Caldin, M. Multidetector Row Computed Tomography and Ultrasound Characteristics of Caudal Vena Cava Duplication in Dogs. Vet. Radiol. Ultrasound 2014, 55, 521–530.
- Zwingenberger, A.L.; Schwarz, T.; Saunders, H.M. Helical Computed Tomographic Angiography of Canine Portosystemic Shunts. Vet. Radiol. Ultrasound 2005, 46, 27–32. [CrossRef] [PubMed]
- White, R.N.; Burton, C.A.; McEvoy, F.J. Surgical Treatment of Intrahepatic Portosystemic Shunts in 45 Dogs. Vet. Rec. 1998, 142, 358–365.
- Lamb, C.R.; White, R.N. Morphology of Congenital Intrahepatic Portacaval Shunts in Dogs and Cats. Vet. Rec. 1998, 142, 55–60.
- Parry, A.T.; White, R.N. Comparison of Computed Tomographic Angiography and Intraoperative Mesenteric Portovenography for Extrahepatic Portosystemic Shunts. J. Small Anim. Pract. 2017, 58, 49–55.
- White, R.N.; Burton, C.A. Anatomy of the Patent Ductus Venosus in the Dog. Vet. Rec. 2000, 146, 425–429.
- Payne, J.T.; Martin, R.A.; Constantinescu, G.M. The Anatomy and Embryology of Portosystemic Shunts in Dogs and Cats. Semin. Vet. Med. Surg. Small Anim. 1990, 5, 76–82.
- Lamb, C.R.; Burton, C.A. Doppler Ultrasonographic Assessment of Closure of the Ductus Venosus in Neonatal Irish Wolfhounds. Vet. Rec. 2004, 155, 699–701.
- Strickland, R.; Tivers, M.S.; Adamantos, S.E.; Harcourt-Brown, T.R.; Fowkes, R.C.; Lipscomb, V.J. Incidence and Risk Factors for Neurological Signs after Attenuation of Single Congenital Portosystemic Shunts in 253 Dogs. Vet. Surg. 2018, 47, 745–755.
- White, R.N.; Forster-van Hijfte, M.A.; Petrie, G.; Lamb, C.R.; Hammond, R.A. Surgical Treatment of Intrahepatic Portosystemic Shunts in Six Cats. Vet. Rec. 1996, 139, 314–317.
- Tivers, M.; Lipscomb, V. Congenital Portosystemic Shunts in Cats: Investigation, Diagnosis and Stabilisation. J. Feline Med. Surg. 2011, 13, 173–184.
- Leeman, J.J.; Kim, S.E.; Reese, D.J.; Risselada, M.; Ellison, G.W. Multiple Congenital PSS in a Dog: Case Report and Literature Review. J. Am. Anim. Hosp. Assoc. 2013, 49, 281–285.
- Gow, A.G. Hepatic Encephalopathy. Vet. Clin. N. Am. Small Anim. Pract. 2017, 47, 585–599.
- Lidbury, J.A.; Cook, A.K.; Steiner, J.M. Hepatic Encephalopathy in Dogs and Cats. J. Vet. Emerg. Crit. Care 2016, 26, 471–487.
- Ferenci, P.; Lockwood, A.; Mullen, K.; Tarter, R.; Weissenborn, K.; Blei, A.T. Hepatic Encephalopathy—Definition, Nomenclature, Diagnosis, and Quantification: Final Report of the Working Party at the 11th World Congresses of Gastroenterology, Vienna, 1998. Hepatology 2002, 35, 716–721.
- Szatmári, V.; Rothuizen, J.; van den Ingh, T.S.G.M.; van Sluijs, F.J.; Voorhout, G. Ultrasonographic Findings in Dogs with Hyperammonemia: 90 Cases (2000–2002). J. Am. Vet. Med. Assoc. 2004, 224, 717–727.
- Proot, S.; Biourge, V.; Teske, E.; Rothuizen, J. Soy Protein Isolate versus Meat-Based Low-Protein Diet for Dogs with Congenital Portosystemic Shunts. J. Vet. Intern. Med. 2009, 23, 794–800.
- Jalan, R.; Shawcross, D.; Davies, N. The Molecular Pathogenesis of Hepatic Encephalopathy. Int. J. Biochem. Cell Biol. 2003, 35, 1175–1181.
- Keiding, S.; Sørensen, M.; Bender, D.; Munk, O.L.; Ott, P.; Vilstrup, H. Brain Metabolism of 13N-Ammonia during Acute Hepatic Encephalopathy in Cirrhosis Measured by Positron Emission Tomography. Hepatology 2006, 43, 42–50.
- Bhatia, V.; Singh, R.; Acharya, S.K. Predictive Value of Arterial Ammonia for Complications and Outcome in Acute Liver Failure. Gut 2006, 55, 98–104.
- Rothuizen, J.; van den Ingh, T.S.G.A.M. Arterial and Venous Ammonia Concentrations in the Diagnosis of Canine Hepato- Encephalopathy. Res. Vet. Sci. 1982, 33, 17–21. [CrossRef]
- Shawcross, D.; Jalan, R. The Pathophysiologic Basis of Hepatic Encephalopathy: Central Role for Ammonia and Inflammation. Cell. Mol. Life Sci. 2005, 62, 2295–2304.
- Coltart, I.; Tranah, T.H.; Shawcross, D.L. Inflammation and Hepatic Encephalopathy. Arch. Biochem. Biophys. 2013, 536, 189–196.
- Gow, A.G.; Marques, A.I.; Yool, D.A.; Crawford, K.; Warman, S.M.; Eckersall, P.D.; Jalan, R.; Mellanby, R.J. Dogs with Congenital Porto-Systemic Shunting (CPSS) and Hepatic Encephalopathy Have Higher Serum Concentrations of C-Reactive Protein than Asymptomatic Dogs with CPSS. Metab. Brain Dis. 2012, 27, 227–229.
- Tivers, M.S.; Handel, I.; Gow, A.G.; Lipscomb, V.J.; Jalan, R.; Mellanby, R.J. Hyperammonemia and Systemic Inflammatory Response Syndrome Predicts Presence of Hepatic Encephalopathy in Dogs with Congenital Portosystemic Shunts. PLoS ONE 2014, 9, e82303.
- Howe, L.M.; Boothe, D.M.; Boothe, H.W. Endotoxemia Associated with Experimentally Induced Multiple Portosystemic Shunts in Dogs. Am. J. Vet. Res. 1997, 58, 83–88.
- Cullen, J.; van den Ingh, T.; Bunch, S.; Rothuizen, J.; Washabau, R.; Desmet, V. Morphological Classification of Circulatory Disorders of the Canine and Feline Liver. In WSAVA Standards for Clinical and Histological Diagnosis of Canine and Feline Liver Diseases; WSAVA Liver Standardization Group, Ed.; Saunders Elsevier: St. Louis, MO, USA, 2006; pp. 41–60.
- Kelley, D.; Lester, C.; Delaforcade, A.; Webster, C.R.L. Thromboelastographic Evaluation of Dogs with Congenital Portosystemic Shunts. J. Vet. Intern. Med. 2013, 27, 1262–1267.
- Kummeling, A.; Teske, E.; Rothuizen, J.; van Sluijs, F.J. Coagulation Profiles in Dogs with Congenital Portosystemic Shunts before and after Surgical Attenuation. J. Vet. Intern. Med. 2006, 20, 1319–1326.
- Hunt, G.B.; Kummeling, A.; Tisdall, P.L.C.; Marchevsky, A.M.; Liptak, J.M.; Youmans, K.R.; Goldsmid, S.E.; Beck, J.A. Outcomes of Cellophane Banding for Congenital Portosystemic Shunts in 106 Dogs and 5 Cats. Vet. Surg. 2004, 33, 25–31.
- Mehl, M.L.; Kyles, A.E.; Hardie, E.M.; Kass, P.H.; Adin, C.; Flynn, A.K.; De Cock, H.E.; Gregory, C.R. Evaluation of Ameroid Ring Constrictors for Treatment for Single Extrahepatic Portosystemic Shunts in Dogs: 168 Cases (1995–2001). J. Am. Vet. Med. Assoc. 2005, 226, 2020–2030.
- Holford, A.L.; Tobias, K.M.; Bartges, J.W.; Johnson, B.M. Adrenal Response to Adrenocorticotropic Hormone in Dogs before and after Surgical Attenuation of a Single Congenital Portosystemic Shunt. J. Vet. Intern. Med. 2008, 22, 832–838.
- Tobias, K.M.; Rohrbach, B.W. Association of Breed with the Diagnosis of Congenital Portosystemic Shunts in Dogs: 2400 Cases (1980–2002). J. Am. Vet. Med. Assoc. 2003, 223, 1636–1639.
- Weisse, C.; Berent, A.C.; Todd, K.; Solomon, J.A.; Cope, C. Endovascular Evaluation and Treatment of Intrahepatic Portosystemic Shunts in Dogs: 100 Cases (2001–2011). J. Am. Vet. Med. Assoc. 2014, 244, 78–94.
- Bostwick, D.R.; Twedt, D.C. Intrahepatic and Extrahepatic Portal Venous Anomalies in Dogs: 52 Cases (1982–1992). J. Am. Vet. Med. Assoc. 1995, 206, 1181–1185.
- Lamb, C.R.; Forster-van Hijfte, M.A.; White, R.N.; McEvoy, F.J.; Rutgers, H.C. Ultrasonographic Diagnosis of Congenital Portosystemic Shunt in 14 Cats. J. Small Anim. Pract. 1996, 37, 205–209.
- Rothuizen, J.; van den Ingh, T.S.G.A.M.; Voorhoutm, G.; van dER Luer, R.J.T.;Wouda,W. Congenital Portosystemic Shunts in Sixteen Dogs and Three Cats. J. Small Anim. Pract. 1982, 23, 67–81.
- Hunt, G.B. Effect of Breed on Anatomy of Portosystemic Shunts Resulting from Congenital Diseases in Dogs and Cats: A Review of 242 Cases. Aust. Vet. J. 2004, 82, 746–749.
- Tillson, D.M.; Winkler, J.T. Diagnosis and Treatment of Portosystemic Shunts in the Cat. Vet. Clin. N. Am.-Small Anim. Pract. 2002, 32, 881–899.
- Blaxter, A.C.; Holt, P.E.; Pearson, G.R.; Gibbs, C.; Gruffydd-Jones, T.J. Congenital Portosystemic Shunts in the Cat: A Report of Nine Cases. J. Small Anim. Pract. 1988, 29, 631–645. [CrossRef]
- van Steenbeek, F.G.; Leegwater, P.A.J.; van Sluijs, F.J.; Heuven, H.C.M.; Rothuizen, J. Evidence of Inheritance of Intrahepatic Portosystemic Shunts in Irish Wolfhounds. J. Vet. Intern. Med. 2009, 23, 950–952.
- Kerr, M.G.; Van Doorn, T. Mass Screening of IrishWolfhound Puppies for Portosystemic Shunts by the Dynamic Bile Acid Test. Vet. Rec. 1999, 144, 693–696.
- Meyer, H.P.; Rothuizen, J.; Ubbink, G.J.; van den Ingh, T.S. Increasing Incidence of Hereditary Intrahepatic Portosystemic Shunts in Irish Wolfhounds in The Netherlands (1984 to 1992). Vet. Rec. 1995, 136, 13–16.
- Worley, D.R.; Holt, D.E. Clinical Outcome of Congenital Extrahepatic Portosystemic Shunt Attenuation in Dogs Aged Five Years and Older: 17 Cases (1992–2005). J. Am. Vet. Med. Assoc. 2008, 232, 722–727.
- Winkler, J.T.; Bohling, M.W.; Tillson, M.D.; Wright, J.C.; Ballagas, A.J. Portosystemic Shunts: Diagnosis, Prognosis, and Treatment of 64 Cases (1993–2001). J. Am. Anim. Hosp. Assoc. 2003, 39, 169–185.
- Boothe, H.W.; Howe, L.M.; Edwards, J.F.; Slater, M.R. Multiple Extrahepatic Portosystemic Shunts in Dogs: 30 Cases (1981–1993). J. Am. Vet. Med. Assoc. 1996, 208, 1849–1854.
- Fryer, K.J.; Levine, J.M.; Peycke, L.E.; Thompson, J.A.; Cohen, N.D. Incidence of Postoperative Seizures with and without Levetiracetam Pretreatment in Dogs Undergoing Portosystemic Shunt Attenuation. J. Vet. Intern. Med. 2011, 25, 1379–1384.
- van den Ingh, T.S.G.A.M.; Rothuizen, J.; Meyer, H.P. Circulatory Disorders of the Liver in Dogs and Cats. Vet. Q. 1995, 17, 70–76.
- Berent, A.C.; Tobias, K.M. Portosystemic Vascular Anomalies. Vet. Clin. N. Am. Small Anim. Pract. 2009, 39, 513–541. [CrossRef]
- Havig, M.; Tobias, K.M. Outcome of Ameroid Constrictor Occlusion of Single Congenital Extrahepatic Portosystemic Shunts in Cats: 12 Cases (1993–2000). J. Am. Vet. Med. Assoc. 2002, 220, 337–341.
- Lipscomb, V.J.; Jones, H.J.; Brockman, D.J. Complications and Long-Term Outcomes of the Ligation of Congenital Portosystemic Shunts in 49 Cats. Vet. Rec. 2007, 160, 465–470.
- Caporali, E.H.G.; Phillips, H.; Underwood, L.; Selmic, L.E. Risk Factors for Urolithiasis in Dogs with Congenital Extrahepatic Portosystemic Shunts: 95 Cases (1999–2013). J. Am. Vet. Med. Assoc. 2015, 246, 530–536.
- Dear, J.D.; Shiraki, R.; Ruby, A.L.; Westropp, J.L. Feline Urate Urolithiasis: A Retrospective Study of 159 Cases. J. Feline Med. Surg. 2011, 13, 725–732.
- van Gundy, T.E.; Boothe, H.W.; Wolf, A. Results of Surgical Management of Feline Portosystemic Shunts. J. Am. Anim. Hosp. Assoc. 1990, 26, 55–62.
- Lipscomb, V.J.; Lee, K.C.; Lamb, C.R.; Brockman, D.J. Association of Mesenteric Portovenographic Findings with Outcome in Cats Receiving Surgical Treatment for Single Congenital Portosystemic Shunts. J. Am. Vet. Med. Assoc. 2009, 234, 221–228.
- Lamb, C. Ultrasonographic Diagnosis of Congenital Portosystemic Shunts on Dogs: Results of a Prospective Study. Vet. Radiol. Ultrasound 1996, 37, 281–288.
- Kyles, A.E.; Hardie, E.M.; Mehl, M.; Gregory, C.R. Evaluation of Ameroid Ring Constrictors for the Management of Single Extrahepatic Portosystemic Shunts in Cats: 23 Cases (1996–2001). J. Am. Vet. Med. Assoc. 2002, 220, 1341–1347.
- Deppe, T.A.; Center, S.A.; Simpson, K.W.; Erb, H.N.; Randolph, J.F.; Dykes, N.L.; Yeager, A.E.; Reynolds, A.J. Glomerular Filtration Rate and Renal Volume in Dogs with Congenital Portosystemic Vascular Anomalies before and after Surgical Ligation. J. Vet. Intern. Med. 1999, 13, 465–471.
- Scavelli, T.D.; Hornbuckle,W.E.; Roth, L.; Rendano, V.T.; de Lahunta, A.; Center, S.A.; French, T.W.; Zimmer, J.F. Portosystemic Shunts in Cats: Seven Cases (1976-1984). J. Am. Vet. Med. Assoc. 1986, 189, 317–325.
- Kraun, M.B.; Nelson, L.L.; Hauptman, J.G.; Nelson, N.C. Analysis of the Relationship of Extrahepatic Portosystemic Shunt Morphology with Clinical Variables in Dogs: 53 Cases (2009–2012). J. Am. Vet. Med. Assoc. 2014, 245, 540–549.
- Sura, P.A.; Tobias, K.M.; Morandi, F.; Daniel, G.B.; Echandi, R.L. Comparison of 99mTcO4(-) Trans-Splenic Portal Scintigraphy with per-Rectal Portal Scintigraphy for Diagnosis of Portosystemic Shunts in Dogs.Vet. Surg. 2007, 36, 654–660.
- Simpson, K.W.; Meyer, D.J.; Boswood, A.; White, R.N.; Maskell, I.E. Iron Status and Erythrocyte Volume in Dogs with Congenital Portosystemic Vascular Anomalies. J. Vet. Intern. Med. 1997, 11, 14–19.
- Bunch, S.E.; Jordan, H.L.; Sellon, R.K.; Cullen, J.M.; Smith, J.E. Characterization of Iron Status in Young Dogs with Portosystemic Shunt. Am. J. Vet. Res. 1995, 56, 853–858.
- Laflamme, D.P.; Mahaffey, E.A.; Allen, S.W.; Twedt, D.C.; Prasse, K.W.; Huber, T.L. Microcytosis and Iron Status in DogsWith Surgically Induced Portosystemic Shunts. J. Vet. Intern. Med. 1994, 8, 212–216.
- Frowde, P.E.; Gow, A.G.; Burton, C.A.; Powell, R.; Lipscomb, V.J.; House, A.K.; Mellanby, R.J.; Tivers, M.S. Hepatic Hepcidin Gene Expression in Dogs with a Congenital Portosystemic Shunt. J. Vet. Intern. Med. 2014, 28, 1203–1205.
- Watson, P.J.; Herrtage, M.E. Medical Management of Congenital Portosystemic Shunts in 27 Dogs-a Retrospective Study. J. Small Anim. Pract. 1998, 39, 62–68.
- Papazoglou, L.G.; Monnet, E.; Seim, H.B. Survival and Prognostic Indicators for Dogs with Intrahepatic Portosystemic Shunts: 32 Cases (1990–2000). Vet. Surg. 2002, 31, 561–570.
- Webster, C.R.L. Hemostatic Disorders Associated with Hepatobiliary Disease. Vet. Clin. N. Am. Small Anim. Pract. 2017, 47, 601–615.
- Toulza, O.; Center, S.; Brooks, M.B.; Erb, H.N.;Warner, K.L.; Deal,W. Evaluation of Plasma Protein C Activity for Detection of Hepatobiliary Disease and Portosystemic Shunting in Dogs. J. Am. Vet. Med. Assoc. 2006, 229, 1761–1771.
- Niles, J.D.; Williams, J.M.; Cripps, P.J. Hemostatic Profiles in 39 Dogs with Congenital Portosystemic Shunts. Vet. Surg. 2001, 30, 97–104.
- Prins, M.; Schellens, C.J.M.M.; van Leeuwen, M.W.; Rothuizen, J.; Teske, E. Coagulation Disorders in Dogs with Hepatic Disease. Vet. J. 2010, 185, 163–168.
- Roy, R.G.; Post, G.S.; Waters, D.J.; Hardy, R.M. Portal Vein Thrombosis as a Complication of Portosystemic Shunt Ligation in Two Dogs. J Am Anim. Hosp. Assoc. 1992, 28, 53–58.
- Tzounos, C.E.; Tivers, M.S.; Adamantos, S.E.; English, K.; Rees, A.L.; Lipscomb, V.J. Haematology and Coagulation Profiles in Cats with Congenital Portosystemic Shunts. J. Feline Med. Surg. 2017, 19, 1290–1296.
- Center, S.A.; Magne, M.L. Historical, Physical Examination, and Clinicopathologic Features of Portosystemic Vascular Anomalies in the Dog and Cat. Semin. Vet. Med. Surg. (Small Anim.) 1990, 5, 83–93.
- Broome, C.J.; Walsh, V.P.; Braddock, J. a Congenital Portosystemic Shunts in Dogs and Cats. N. Z. Vet. J. 2004, 52, 154–162.
- Johnson, C.A.; Armstrong, P.J.; Hauptman, J.G. Congenital Portosystemic Shunts in Dogs: 46 Cases (1979–1986). J. Am. Vet. Med. Assoc. 1987, 191, 1478–1483.
- Center, S.A.; ManWarren, T.; Slater, M.R.; Wilentz, E. Evaluation of Twelve-Hour Preprandial and Two-Hour Postprandial Serum Bile Acids Concentrations for Diagnosis of Hepatobiliary Disease in Dogs. J. Am. Vet. Med. Assoc. 1991, 199, 217–226.
- Center, S.A.; Erb, H.N.; Joseph, S.A. Measurement of Serum Bile Acids Concentrations for Diagnosis of Hepatobiliary Disease in Cats. J. Am. Vet. Med. Assoc. 1995, 207, 1048–1054.
- Center, S.A.; Baldwin, B.H.; Erb, H.; Tennant, B.C. Bile Acid Concentrations in the Diagnosis of Hepatobiliary Disease in the Cat. J. Am. Vet. Med. Assoc. 1986, 189, 891–896.
- Center, S.A.; Baldwin, B.H.; de Lahunta, A.; Dietze, A.E.; Tennant, B.C. Evaluation of Serum Bile Acid Concentrations for the Diagnosis of Portosystemic Venous Anomalies in the Dog and Cat. J. Am. Vet. Med. Assoc. 1985, 186, 1090–1094.
- Ruland, K.; Fischer, A.; Hartmann, K. Sensitivity and Specificity of Fasting Ammonia and Serum Bile Acids in the Diagnosis of Portosystemic Shunts in Dogs and Cats. Vet. Clin. Pathol. 2010, 39, 57–64.
- Jensen, A.L. Evaluation of Fasting and Postprandial Total Serum Bile Acid Concentration in Dogs with Hepatobiliary Disorders. Zentralbl. Veterinarmed. A 1991, 38, 247–254.
- Chapman, S.E.; Hostutler, R.A. A Laboratory Diagnostic Approach to Hepatobiliary Disease in Small Animals. Vet. Clin. N. Am. Small Anim. Pract. 2013, 43, 1209–1225.
- Allen, L.; Stobie, D.; Mauldin, G.N.; Baer, K.E. Clinicopathologic Features of Dogs with Hepatic Microvascular Dysplasia with and without Portosystemic Shunts: 42 Cases (1991–1996). J. Am. Vet. Med. Assoc. 1999, 214, 218–220.
- Tisdall, P.L.; Hunt, G.B.; Bellenger, C.R.; Malik, R. Congenital Portosystemic Shunts in Maltese and Australian Cattle Dogs. Aust. Vet. J. 1994, 71, 174–178.
- Deitz, K.L.; Makielski, K.M.; Williams, J.M.; Lin, H.; Morrison, J.A. Effect of 6-8 Weeks of Oral Ursodeoxycholic Acid Administration on Serum Concentrations of Fasting and Postprandial Bile Acids and Biochemical Analytes in Healthy Dogs. Vet. Clin. Pathol. 2015, 44, 431–436.
- Strombeck, D.R.; Meyer, D.J.; Freedland, R.A. Hyperammonemia Due to a Urea Cycle Enzyme Deficiency in Two Dogs. J. Am. Vet. Med. Assoc. 1975, 166, 1109–1111.
- Zandvliet, M.M.J.M.; Rothuizen, J. Transient Hyperammonemia Due to Urea Cycle Enzyme Deficiency in IrishWolfhounds. J. Vet. Intern. Med. 2007, 21, 215–218.
- Walker, M.C.; Hill, R.C.; Guilford, W.G.; Scott, K.C.; Jones, G.L.; Buergelt, C.D. Postprandial Venous Ammonia Concentrations in the Diagnosis of Hepatobiliary Disease in Dogs. J. Vet. Intern. Med. 2001, 15, 463–466.
- Whiting, P.G.; Breznock, E.M.; Moore, P.; Kerr, L.; Berger, B.; Gregory, C.; Hornof, W. Partial Hepatectomy with Temporary Hepatic Vascular Occlusion in Dogs with Hepatic Arteriovenous Fistulas. Vet. Surg. 1986, 15, 171–180.
- van Straten, G.; Spee, B.; Rothuizen, J.; van Straten, M.; Favier, R.P. Diagnostic Value of the Rectal Ammonia Tolerance Test, Fasting Plasma Ammonia and Fasting Plasma Bile Acids for Canine Portosystemic Shunting. Vet. J. 2015, 204, 282–286.
- Rothuizen, J.; van den Ingh, T.S.G.A.M. Rectal Ammonia Tolerance Test in the Evaluation of Portal Circulation in Dogs with Liver Disease. Res. Vet. Sci. 1982, 33, 22–25.
- Meyer, H.P.; Rothuizen, J.; Tiemessen, I.; Van Den Brom, W.E.; Van Den Ingh, T.S.G.A.M. Transient Metabolic Hyperammonaemia in Young Irish Wolfhounds. Vet. Rec. 1996, 138, 105–107.
- Danese, S.; Vetrano, S.; Zhang, L.; Poplis, V.A.; Castellino, F.J. The Protein C Pathway in Tissue Inflammation and Injury: Pathogenic Role and Therapeutic Implications. Blood 2010, 115, 1121–1130.
- Aird,W.C. Natural Anticoagulant Inhibitors: Activated Protein C. Best Pract. Res. Clin. Haematol. 2004, 17, 161–182.
- Sunlight, C.;Weisse, C.; Berent, A.; Tozier, E. Protein C and Comparative Biochemical Changes in Dogs Treated with Percutaneous Transvenous Coil Embolization of Congenital Intrahepatic Portosystemic Shunts. Vet. Surg. 2022, 51, 125–135.
- Tarnow, I.; Falk, T.; Tidholm, A.; Martinussen, T.; Jensen, A.L.; Olsen, L.H.; Pedersen, H.D.; Kristensen, A.T. Hemostatic Biomarkers in Dogs with Chronic Congestive Heart Failure. J. Vet. Intern. Med. 2007, 21, 451 457.
- de Laforcade, A.M.; Rozanski, E.A.; Freeman, L.M.; Li, W. Serial Evaluation of Protein C and Antithrombin in Dogs with Sepsis. J. Vet. Intern. Med. 2008, 22, 26–30.
- de Laforcade, A.M.; Freeman, L.M.; Shaw, S.P.; Brooks, M.B.; Rozanski, E.A.; Rush, J.E. Hemostatic Changes in Dogs with Naturally Occurring Sepsis. J. Vet. Intern. Med. 2003, 17, 674–679.
- Lee, K.C.L.; Winstanley, A.; House, J.V.; Lipscomb, V.; Lamb, C.; Gregory, S.; Jalan, R.; Mookerjee, R.P.; Brockman, D.J. Association between Hepatic Histopathologic Lesions and Clinical Findings in Dogs Undergoing Surgical Attenuation of a Congenital Portosystemic Shunt: 38 Cases (2000–2004). J. Am. Vet. Med. Assoc. 2011, 239, 638–645.
- Parker, J.S.; Monnet, E.; Powers, B.E.; Twedt, D.C. Histologic Examination of Hepatic Biopsy Samples as a Prognostic Indicator inDogs Undergoing Surgical Correction of Congenital Portosystemic Shunts: 64 Cases (1997 2005). J. Am. Vet. Med. Assoc. 2008, 232, 1511–1514.
- Isobe, K.; Matsunaga, S.; Nakayama, H.; Uetsuka, K. Histopathological Characteristics of Hepatic Lipogranulomas with Portosystemic Shunt in Dogs. J. Vet. Med. Sci. Jpn. Soc. Vet. Sci. 2008, 70, 133–138.
- Baade, S.; Aupperle, H.; Grevel, V.; Schoon, H.A. Histopathological and Immunohistochemical Investigations of Hepatic Lesions Associated with Congenital Portosystemic Shunt in Dogs. J. Comp. Pathol. 2006, 134, 80 90.
- Swinbourne, F.; Smith, K.C.; Lipscomb, V.J.; Tivers, M.S. Histopathological Findings in the Livers of Cats with a Congenital Portosystemic Shunt before and after Surgical Attenuation. Vet. Rec. 2013, 172, 362.
- Hunt, G.B.; Luff, J.; Daniel, L.; Zwingenberger, A. Does Hepatic Steatosis Have an Impact on the Short Term Hepatic Response after Complete Attenuation of Congenital Extrahepatic Portosystemic Shunts? A Prospective Study of 20 Dogs. Vet. Surg. 2014, 43, 920–925.
- Lamb, C.R. Ultrasonography of Portosystemic Shunts in Dogs and Cats. Vet. Clin. N. Am. Small Anim. Pract. 1998, 28, 725–753.
- Tiemessen, I.; Rothuizen, J.; Voorhout, G. Ultrasonography in the Diagnosis of Congenital Portosystemic Shunts in Dogs. Vet. Q. 1995, 17, 50–53.
- D’Anjou, M.A.; Penninck, D.; Cornejo, L.; Pibarot, P. Ultrasonographic Diagnosis of Portosystemic Shunting in Dogs and Cats. Vet. Radiol. Ultrasound 2004, 45, 424–437.
- Szatmári, V.; Rothuizen, J.; Voorhout, G. Standard Planes for Ultrasonographic Examination of the Portal System in Dogs. J. Am. Vet. Med. Assoc. 2004, 224, 713–716, 698–699.
- Holt, D.E.; Schelling, C.G.; Saunders, H.M.; Orsher, R.J. Correlation of Ultrasonographic Findings with Surgical, Portographic, and Necropsy Findings in Dogs and Cats with Portosystemic Shunts: 63 Cases (1987 1993). J. Am. Vet. Med. Assoc. 1995, 207, 1190–1193.
- Berent, A.; Weisse, C. Hepatic Vascular Anomalies. In Textbook of Veterinary Internal Medicine; Ettinge, S., Feldman, E., Eds.; Elsevier: St. Louis, MO, USA, 2010; pp. 1649–1671.
- Kim, S.E.; Giglio, R.F.; Reese, D.J.; Reese, S.L.; Bacon, N.J.; Ellison, G.W. Comparison of Computed Tomographic Angiography and Ultrasonography for the Detection and Characterization of Portosystemic Shunts in Dogs. Vet. Radiol. Ultrasound 2013, 54, 569–574.
- Nelson, N.C.; Nelson, L.L. Anatomy of Extrahepatic Portosystemic Shunts in Dogs as Determined by Computed Tomography Angiography. Vet. Radiol. Ultrasound 2011, 52, 498–506.
- Zwingenberger, A. CT Diagnosis of Portosystemic Shunts. Vet. Clin. N. Am.-Small Anim. Pract. 2009, 39, 783–792.
- Bertolini, G.; Rolla, E.C.; Zotti, A.; Caldin, M. Three-Dimensional Multislice Helical Computed Tomography Techniques for Canine Extra-Hepatic Portosystemic Shunt Assessment. Vet. Radiol. Ultrasound 2006, 47, 439–443.
- Mai, W.; Weisse, C. Contrast-Enhanced Portal Magnetic Resonance Angiography in Dogs with Suspected Congenital Portal Vascular Anomalies. Vet. Radiol. Ultrasound 2011, 52, 284–288.
- Seguin, B.; Tobias, K.M.; Gavin, P.R.; Tucker, R.L. Use of Magnetic Resonance Angiography for Diagnosis of Portosystemic Shunts in Dogs. Vet. Radiol. Ultrasound 1999, 40, 251–258.
- Bruehschwein, A.; Foltin, I.; Flatz, K.; Zoellner, M.; Matis, U. Contrast Enhanced Magnetic Resonance Angiography for Diagnosis of Portosystemic Shunts in 10 Dogs. Vet. Radiol. Ultrasound 2010, 51, 116–121.
- Christiansen, J.S.; Hottinger, H.A.; Allen, L.; Phillips, L.; Aronson, L.R. Hepatic Microvascular Dysplasia in Dogs: A Retrospective Study of 24 Cases (1987–1995). J. Am. Anim. Hosp. Assoc. 2000, 36, 385–389.
- Schermerhorn, T.; Center, S.A.; Dykes, N.L.; Rowland, P.H.; Yeager, A.E.; Erb, H.N.; Oberhansley, K.; Bonda, M. Characterization of Hepatoportal Microvascular Dysplasia in a Kindred of Cairn Terriers. J. Vet. Intern. Med. 1996, 10, 219–230.