Определение понятия мастоцитомы у собак
Мастоцитома у собак — это новообразование происходящее из тучных клеток (мастоцитов), которое считается самым распространённым новообразованием кожи у собак (1-5)(рисунок 1). Помимо кожи, мастоцитомы встречаются в других тканях и органах организма (подкожные ткани, ротовая полость, половые органы, органы желудочно-кишечного тракта и другие), также существует системная форма болезни — системный мастоцитоз.
Мастоцитомы относят к группе круглоклеточных опухолей, особенностью которых является наличие цитоплазматических гранул, содержащих в себе биологически активные вещества (гистамин, гепарин, протеазы, цитокины). Другой особенностью мастоцитом является разнообразное биологическое поведение (от относительно доброкачественного, до крайне агрессивного и злокачественного), связанное со степенью дифференцировки опухоли, ее локализации и ряда других факторов.
Синонимы: тучноклеточная опухоль, саркома тучных клеток.
Сокращения: ЖКТ — желудочно-кишечный тракт.
Оглавление
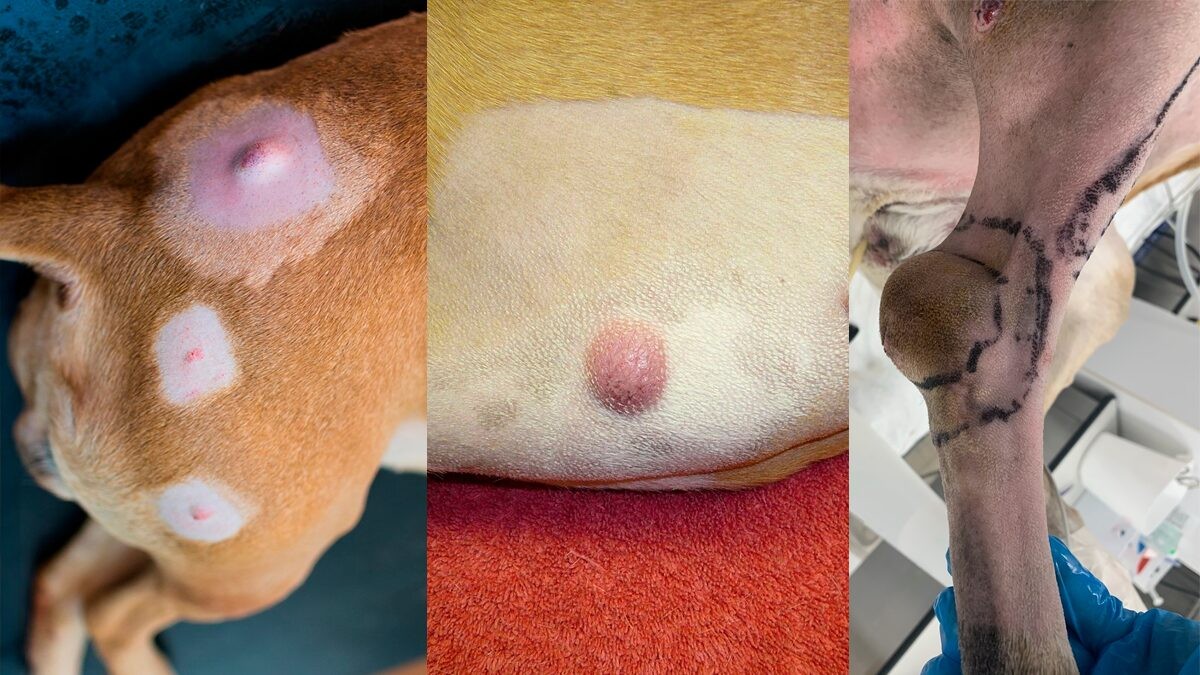
Рисунок 1. Мастоцитома у собак — фотографии опухолей различной локализации.
Нормальная биология мастоцитов у собак
Предшественники мастоцитов покидают костный мозг и мигрируют в различные ткани по всему телу, где они дифференцируются в зрелые мастоциты с наличием характерных цитоплазматических гранул (6). Эти гранулы содержат в себе биологически активные вещества — гепарин, гистамин, фактор некроза опухоли-альфа и протеазы. Состав этих веществ варьируется и связан с местом созревания мастоцита в организме (7). При стимуляции мастоцитов, происходит выход этих биологических веществ из гранул в окружающие ткани (видео 1 и рисунок 2), благодаря чему, мастоциты учувствуют в процессе заживления ран, начальном иммунном ответе, противопаразитарной активности и модулируют иммунный ответ при укусах ядовитых животных (6, 8).

Видео 1. Анимация показывает процесс дегрануляции мастоцита под воздействием аллергена, что приводит к выходу в ткани биологически активных веществ.
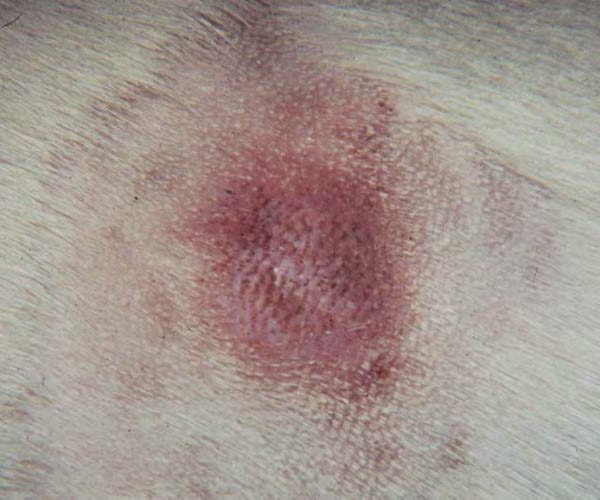
Рисунок 2. Выход биологически активных веществ из-за дегрануляции мастоцитов у собаки с мастоцитомой. На фотографии можно увидеть покраснение кожи вокруг образования (симптом Дарье).
Эпидемиология и факторы риска мастоцитом у собак
Мастоцитома у собак является самой распространенной опухолью кожи и составляет 16-21% от всех кожных новообразований (1, 3, 5, 12).
Мастоцитомы обычно диагностируют у пожилых собак в возрасте 8-9 лет, однако они могут встречаться и в более молодом возрасте. Половая предрасположенность не выявлена.
К наиболее предрасположенным породам относят: боксеров, бостон-терьеров, английских бульдогов, мопсов, лабрадоров и золотистых ретриверов, кокер-спаниелей, шнауцеров, стаффордширских терьеров, биглей, риджбеков, веймаранеров и шарпеев (1, 5, 13-15). Для бульдогов характерено менее агрессивное биологическое поведение мастоцитом, а шарпеев — более агрессивное (1, 17).
Описаны случаи спонтанной регрессии мастоцитом в молодом возрасте у кошек, свиней, лошадей и людей. Есть публикация о регрессии множественных кожных мастоцитом в течение 27 недель у 3-месячного джек рассел терьера (18). Такая спонтанная регрессия мастоцитом у молодых животных скорее всего связана с гиперпластическим или диспластическим синдромом, чем с истинным опухолевым процессом.
Точная причина появления мастоцитом неизвестна. Исторически считалось, что появление опухолей связано с хроническим воспалением или воздействием кожного аллергена, однако в дальнейших исследованиях это не подтвердилось (19-21). Вирусная и трансмиссивная теория также не подтвердились (22-25).
Нарушения в геноме, которые могут предрасполагать собак к развитию мастоцитом не до конца понятны. Нарушения в работе гена-опухолевого супрессора p53 выявлены у некоторых собак с мастоцитомами (26-28), однако в большинстве других случаев, данные отклонения отсутствовали (29). Нарушение экспрессии протеинов p21 и p27, ингибиторов циклин-зависимой киназы, которые отвечают за регуляцию клеточного цикла выявлены во множестве мастоцитом собак (30). Цитозольные рецепторы к эстрогену и прогестерону были также выявлены в мастоцитомах собак (31), однако их роль в развитии опухолей не ясна (32). Экспрессия ангиогенного фактора роста VEGF и его рецепторов VEGFR2 была выявлена во множестве мастоцитом собак и их активация может быть связана с более плохими результатами хирургического лечения (33, 34).
Наиболее хорошо описанное отклонение у собак с мастоцитомами — это мутация рецептора тирозинкиназы (KIT). В норме данные рецепторы встречаются на большом количестве гемопоэтических стволовых клеток, меланоцитов и мастоцитов (35-37). В норме лиганд к рецептору KIT и фактор роста стволовых клеток стимулируют пролиферацию, дифференциацию и созревание нормальных мастоцитов. В мастоцитомах собак выявлена экспрессия рецепторов KIT, однако его функция часто нарушена из-за мутации (38-42). Данная мутация приводит к независимой от фактора роста стволовых клеток активации рецептора с последующей трансдукцией (43-47). Такие c-kit мутации встречаются в 25-30% средне- и низкодифференцированных мастоцитом, что в свою очередь повышает риск локальных рецидивов опухоли, метастазирования и ухудшает прогноз (43, 46, 48-50).
В более свежих исследованиях стараются лучше охарактеризовать вариацию числа копий генов, профиль экспрессии генов и протеомный профиль мастоцитом собак для понимания причин, связанных с агрессивным биологическим поведением опухоли (51-56).
Анамнез и клинические симптомы мастоцитом у собак
Большинство мастоцитом у собак развиваются из дермы или подкожных тканей (5, 57) и чаще всего это одиночные опухоли. Однако в 11-14% случаев поражение носят множественный характер (58, 59). Примерно 50% кожных мастоцитом располагаются в области туловища и паха, 40% на конечностях и 10% в области головы и шеи (20, 60)(рисунок 3).
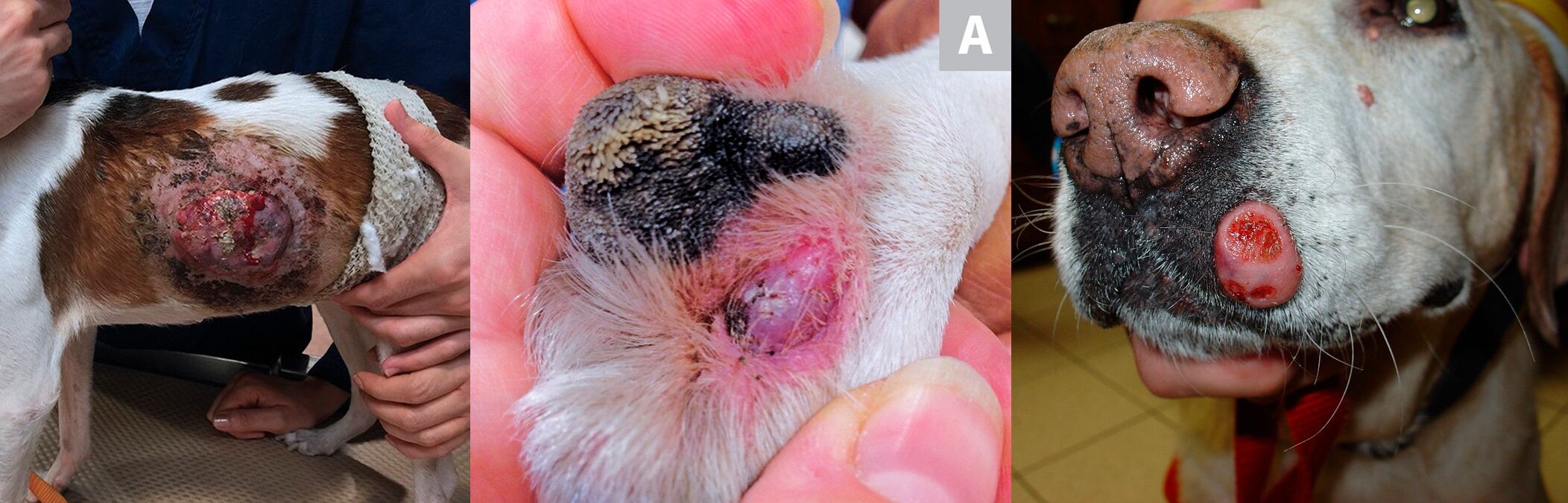
Рисунок 3. Фотографии мастоцитом у собак (слева на право): мастоцитома в области туловища, кисти и губы.
Мастоцитомы могут встречаться в других местах, включая конъюнктиву, слюнную железу, носоглотку, гортань, ротовую полость, мочеточники и позвоночник (61-65). Висцеральную форму мастоцитомы, обычно относят к диссеминированной или системной форме мастоцитоза (66-70). Инфильтрация абдоминальных лимфатических узлов, селезенки, печени и костного мозга, часто отмечается у собак с висцеральной формой заболевания, также описаны перитонеальные и плевральные выпоты, содержащие мастоциты (рисунок 4).
У собак с первичными мастоцитомами желудочно-кишечного тракта основными симптомами были: рвота, диарея и мелена. Только 40% таких собак было живо через 30 дней после первичного обращения и менее 10% животных прожило более 6 месяцев (28).
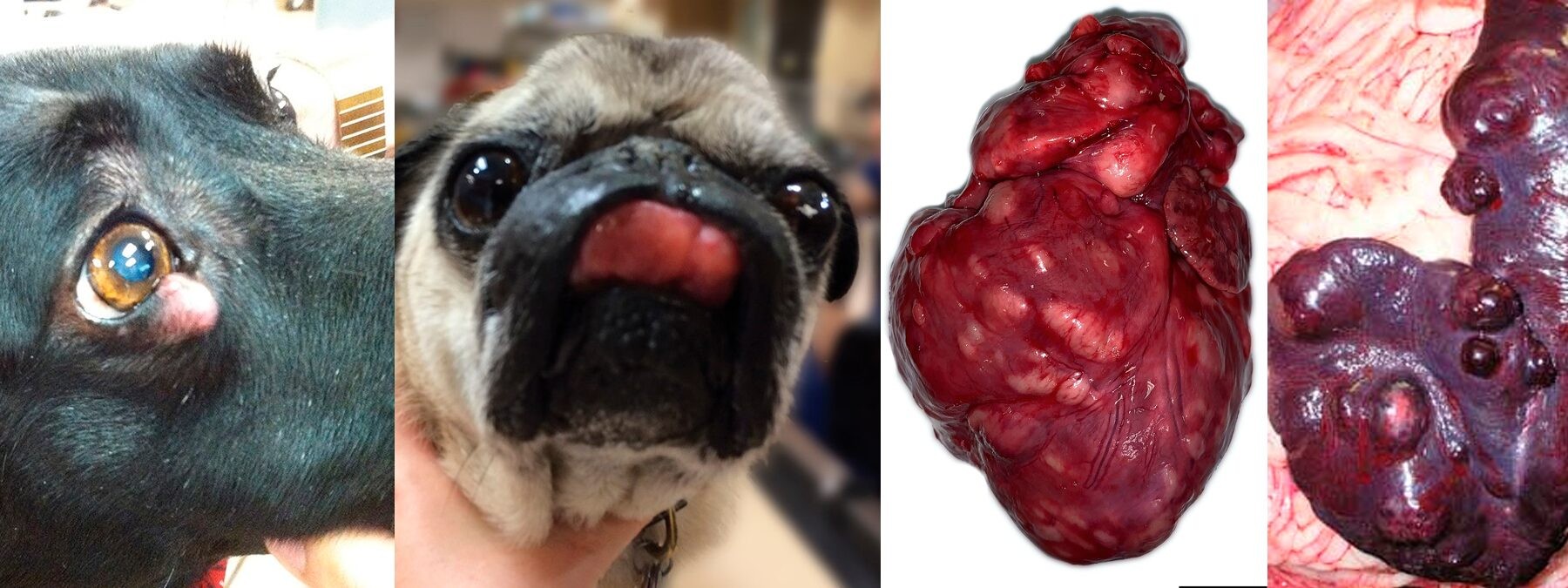
Рисунок 4. Фотографии мастоцитом у собак (слева на право): мастоцитома в области нижнего века, ротовой полости, сердца и селезенки.
Кожная форма мастоцитомы имеет разнообразное проявление и внешний вид (рисунок 5):
- Высокодифференцированные мастоцитомы у собак выглядят как небольшие, одиночные и медленно растущие в течение нескольких месяцев опухоли. Обычно они не имеют язвенных дефектов, однако шерстный покров может отсутствовать.
- Низкодифференцированные мастоцитомы имеют тенденцию к быстрому росту и наличию язвенных дефектов. Окружающие мягкие ткани могут быть воспаленными и отечными. Рядом с основной опухолью не редко есть сателлитные образования.
- Мастоцитомы средней степени дифференцировки могут проявляться себя, как опухоли высокой или низкой дифференцировки.
- Подкожная форма мастоцитомы у собак часто выглядит схожей с липомой.
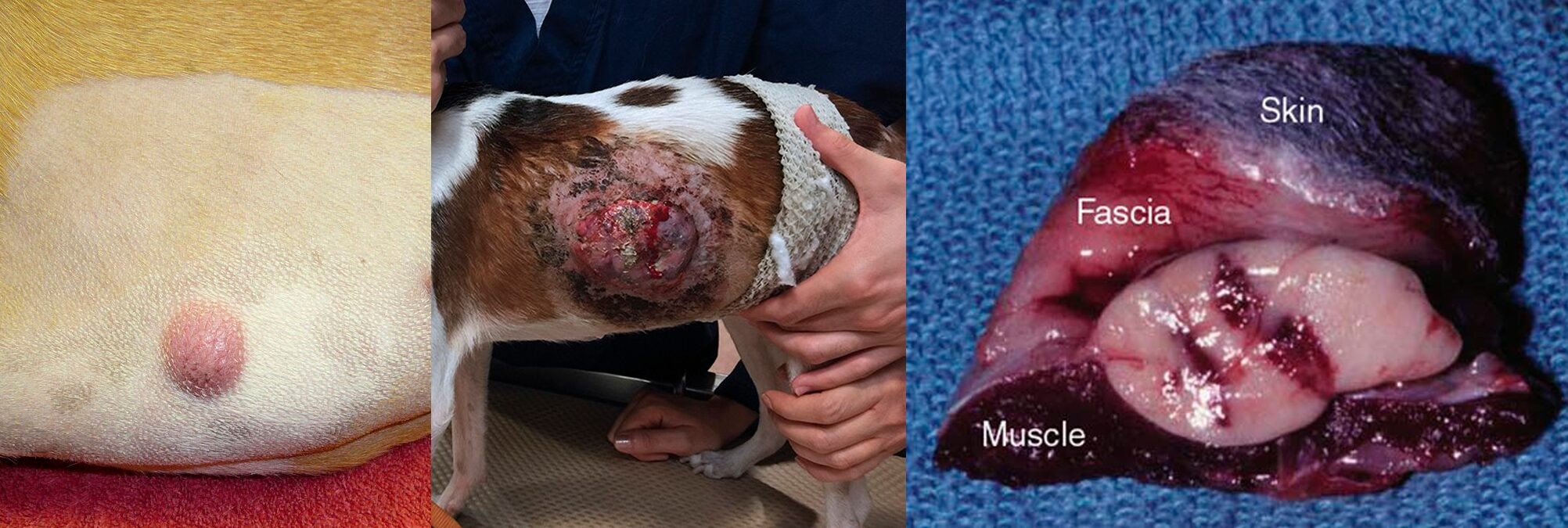
Рисунок 5. Слева на право представлены: высокодифференцированная мастоцитома, низкодифференцированная мастоцитома и удаленный препарат с подкожной мастоцитомой, которая внешне похоже на липому (опухоль из жировой ткани).
Дополнительные сложности могут возникнуть из-за выделения биологически активных веществ из гранул клеток мастоцитомы (гистамина, гепарина и других вазоактивных аминов). Например, в ходе пальпации опухоли, может развиться отек и покраснение окружающих тканей. Этот феномен называют симптомом (феноменом) Дарье (71)(рисунок 2). Высвобождение активных веществ может происходить спонтанно (без явной причины), и владельцы иногда сообщают врачу, что опухоль периодически становится больше или меньше в размерах.
Изъязвления органов желудочно-кишечного тракта (ЖКТ) у собак с мастоцитомами задокументированы в 35-83% случаев во время некропсии (72, 73). Влияние на органы ЖКТ происходит из-за высвобождения гистамина мастоцитомой, который воздействует на H2-гистаминовые рецепторы, что усиливает секрецию соляной кислоты в желудке (74). Также у собак с мастоцитомами отмечаются сниженные концентрации гастрина, который в норме вырабатывают G-клетки в антральном отделе желудка, что дополнительно усугубляет воздействие соляной кислоты.
Поэтому собаки, особенно с объемными мастоцитомами, могут поступать на прием к врачу по поводу рвоты, диареи, лихорадки, периферических отеков и коллапса (редко). Предоперационная дегрануляция мастоцитомы может приводить к гипотензии в ходе операции или нарушению свертываемости крови (68, 75, 76, 77).
Прогностические факторы мастоцитом у собак
Список прогностических факторов, которые влияют на биологическое поведение мастоцитомы и прогноз, представлены в таблице ниже. Стоит понимать, что делая выводы о биологическом поведении мастоцитомы, необходимо учитывать все прогностические факторы в целом, а не какой-то один из них.
Таблица 1. Прогностические факторы для мастоцитом у собак
| Фактор | Описание |
|---|---|
| Степень дифференцировки опухоли | Значимое влияние на исход. Собаки с низкодифференцированными мастоцитомами обычно погибают при проведении только локальной терапии, по сравнению с высокодифференцированными мастоцитомами, когда локальная терапия обычно приводит к излечению. |
| Клиническая стадия | При 0 и 1 стадии, в процесс вовлечены только кожные покровы без метастазов в регионарных лимфатических узлах или отдаленных органах, что значительно улучшает прогноз, по сравнению с более продвинутыми стадиями заболевания. |
| Клеточная пролиферация | Митотический индекс, AgNOR, PCNA, Ri-67 предиктор хирургического исхода лечения. |
| Локализация опухоли | Мастоцитомы расположенные в области слизистых оболочек имеют более низкую степень дифференцировки и худший прогноз. Расположение мастоцитомы в области препуция или мошонки тоже негативно влияет на прогноз. Подкожная форма мастоцитомы имеет более хороший прогноз. Висцеральная форма или поражение костного мозга связаны с неблагоприятным прогнозом. |
| Скорость роста | Мастоцитомы, которые длительное время (месяцы или годы) не увеличиваются в размере, обычно высокодифференцированные. |
| Количество сосудов | Увеличенное количество сосудов связано с более низкой дифференцировкой мастоцитомы, выраженной степенью инвазии в окружающие ткани и худшим прогнозом. |
| Рецидив мастоцитомы | Локальный рецидив мастоцитомы ухудшает прогноз. |
| Системные симптомы | Наличие системных симптомов (рвота, мелена, гипорексия, изъязвление ЖКТ) может быть связано с продвинутой стадией болезни. |
| Возраст | Пожилые собаки имеют более низки безрецидивный период при лечении мастоцитомы облучением по сравнению с молодыми собаками |
| Порода | Мастоцитомы у боксеров (возможно у всех брахицефальных пород собак) чаще средне или высокодифференцированные, что улучшает прогноз. |
| Пол | Самцы имеют меньшую продолжительность жизни по сравнению с самками при лечении опухоли химиотерапией. |
| Размер опухоли | Большие опухоли имеют худший прогноз после хирургического удаления и/или лучевой терапии. |
| C-kit мутация | Наличие мутации ухудшает прогноз. |
| Вариабельность числа копий ДНК | Высокая вариабельность числа копий ДНК связана с плохим прогнозом. |
| AgNOR - области аргирофильных ядрышковых организаторов; CNV - вариация числа копий; ЖКТ - желудочно-кишечный тракт; PCNA - ядерный антиген пролиферирующих клеток. | |
Степень дифференцировки мастоцитомы является самым весомым прогностическим фактором у собак (13, 57, 78, 79). Существует несколько классификаций мастоцитом по степени дифференцировки опухоли (см. таблицу 2). Большинство собак с высокодифференцированными (80-90%) и примерно 75% собак со среднедифференцированными мастоцитомами имеют долгую продолжительность жизни, после полного хирургического удаления опухоли (58, 78, 80-83). Частота метастазирования при низкодифференцированных мастоцитомах варьируется от 55% до 96% случаев и большинство собак погибает в течение 1 года (57, 84).
Чаще всего метастазы появляются в регионарных лимфатических узлах, далее в селезенке и печени. Могут поражаться другие органы (например, легкие), однако это встречается реже. При системном распространении болезни, клетки мастоцитомы, встречаются в костном мозге и периферической крови (68).
Таблица 2. Гистологическая классификация мастоцитом у собак
| Степень | Классификация по Bostock | Классификация по Patnaik | Микроскопическая характеристика |
|---|---|---|---|
| Низкодифференцированная | 1 | 3 | Высококлеточные, недифференцированная цитоплазматическая мембрана, несимметричные ядра, частые митозы, редкие цитоплазматические гранулы |
| Среднедифферецированная | 2 | 2 | Плохо выраженная цитоплазматическая мембрана, соотношение ядро/цитоплазма меньше, чем у низкодифференцированных опухолей, нечастые митозы, большее количество гранул |
| Высокодифференцированная | 3 | 1 | Хорошо выраженная цитоплазматическая мембрана, сферические или овальные ядра, митозов мало или они отсутствуют, большие цитоплазматические гранулы |
Ниже представлена таблица с частотой встречаемости мастоцитом у собак по степени дифференцировки опухолей (по данным ряда исследований).
Таблица 3. Частота встречаемости мастоцитом по степени дифференцировки
Продолжительность жизни собак с мастоцитомами, в зависимости от их степени дифференцировки, после хирургического удаления, представлена в таблице 4.
Таблица 4. Продолжительность жизни после хирургического удаления мастоцитом у собак
| Авторы исследований | Количество собак | Процент выживших | Месяцев после операции | Медиана продолжительности жизни (недели) |
|---|---|---|---|---|
| Bostock (59) | ||||
| Низкодифференцированная | 39 | 79 | 7 | Нет данных |
| Среднедифференцированная | 30 | 37 | 7 | |
| Высокодифференцированная | 45 | 15 | 7 | |
| Patnaik (14) | ||||
| Низкодифференцированная | 30 | 83 | 48 | Нет данных |
| Среднедифференцированная | 36 | 44 | 48 | |
| Высокодифференцированная | 17 | 6 | 48 | |
| Bostock (104) | ||||
| Низкодифференцированная | 19 | 90 | Нет данных | >40 |
| Среднедифференцированная | 16 | 75 | >36 | |
| Высокодифференцированная | 15 | 27 | 13 | |
| Murphy (84) | ||||
| Низкодифференцированная | 87 | 100 | 12 | >80 |
| Среднедифференцированная | 199 | 92 | 12 | >80 |
| Высокодифференцированная | 54 | 46 | 12 | 40 |
| Simoes (85) | ||||
| Низкодифференцированная | 33 | 91 | 20 | Нет данных |
| Среднедифференцированная | 35 | 71 | 20 | |
| Высокодифференцированная | 19 | 42 | 20 | |
Описанные выше системы классификации не могут выявить небольшой процент высоко- и среднедифференцированных мастоцитом, которые приводят к смертельному исходу, что связано с различной интерпретацией данных между патологами. Так в одном исследовании были получены различные заключения патологов при классификации ряда мастоцитом (13, 85, 86).
С целью минимизации таких заключений, была предложена альтернативная классификация по Kiupel, при которой мастоцитомы подразделяли на высоко- и низкодифференцированные (87). По данной классификации, мастоцитому относили к низкодифференцированной если, (1) отмечается не менее 7 митозов в 10 полях зрения, (2) не менее 3 многоядерных клеток в 10 полях зрения, (3) не менее 3 измененных ядер в 10 полях зрения или (4) кариомегалии.
В исследовании проведенном на 95 собаках, оценивалась классификация по Patnaik и Kiupel, по результатам исследования, классификация по Kiupel несколько лучше предсказывала исход болезни (87, 88). На данным момент, большинство практиков используют в своей работе обе системы классификаций.
Были исследованы некоторые маркеры пролиферации для оценки их влияния на биологическое поведение мастоцитомы (49, 79, 89-97). В некоторых ядрах опухолей выявлен белок Ki-67, который влияет на клеточную пролиферацию и выживаемость животных (90, 91). Определение области аргирофильных ядрышковых организаторов (AgNOR), еще одного маркера пролиферации, коррелирует со степенью дифференцировки мастоцитомы и результатами хирургического лечения (79, 98). Ядерный антиген пролиферирующих клеток (PCNA), является другим индикатором пролиферации клеток, который использовался для определения биологического поведения опухоли, однако он оказался не таким информативным по сравнению с другими (79, 98, 99).
Митотический индекс (МИ) оценивает количество митозов в 10 полях зрения, и используется для оценки биологического поведения мастоцитомы у собак. Так по данным одного исследования, если у собаки с мастоцитомой митотический индекс был менее 5, то медиана продолжительности жизни составляла 80 месяцев, а если более 5, то всего 3 месяца (100). Другие исследования тоже показали важную роль количества митозов (87, 97, 101-103).
Исследование плоидности ДНК, при помощи проточной цитометрии, показало тенденцию к более короткой продолжительности жизни и более продвинутой стадии болезни в анеуплоидных опухолях по сравнению с диплоидными (104). Увеличение вариации числа копий ДНК (DNA CNV), связано с более низкой степенью дифференцировки мастоцитомы и короткой продолжительностью жизни (51, 52). Исследования выявили корреляцию между внутриопухолевой микрососудистой плотностью и инвазивностью, митотическим индексом и прогнозом (89, 105), а также корреляцию между ядерной характеристикой и результатом лечения и степенью дифференцировки мастоцитомы (106, 107).
Роль нарушения регуляции работы KIT и прогноза мастоцитом, оценивалась при помощи иммуногистохимического метода (108). Наличие мутаций c-kit, связано с повышенной частотой рецидивов опухоли, метастазирования и летальным исходом (43, 48, 49).
Локализация мастоцитом у собак, оценивалась как прогностический фактор (58, 110-114). Опухоли расположенные в области паха или препуция, ногтевого ложа, кожно-слизистых переходов, ротовой полости, имеют более агрессивное биологическое поведение (111, 112). Примерно 50-60% собак с мастоцитомой расположенной в области губ, имеют метастазы в регионарных лимфатических узлах (113, 115).
Мастоцитомы расположенные в висцеральных органах (желудочно-кишечный тракт, печень, селезенка) или костном мозге имеют неблагоприятный прогноз (67, 68).
Подкожные формы мастоцитомы имеют более хороший прогноз, с длительной продолжительностью жизни и низкой частотой рецидивов. По данным одного исследования, у собак с подкожными мастоцитомами, метастазы отмечались только в 4% случаев, а локальные рецидивы в 8% случаев (103), 2-ух и 5-ти летняя выживаемость составила 92% и 86% соответственно. Более низкая продолжительность жизни, была связана с митотическим индексом более 4, инфильтративным характером роста и наличием многоядерности (103).
Конъюнктивальная локализация мастоцитомы, связана с хорошим прогнозом, так по данным одного исследования, 15 из 32 собак не имели признаков рецидива опухоли через 21,4 месяца после операции и ни одна собака не погибла от мастоцитомы (116).
Клинические стадии мастоцитомы представлены в таблице 5. Стадия заболевания оказывает влияние на прогноз (32, 57, 104, 110, 117, 118).
Возникают сложности при множественном поражении мастоцитомами, так как применение данного стадирования в этих случаях спорно. Например, в нескольких исследованиях было доказано, что нет принципиальной разницы в исходе, между животными с одной или несколькими мастоцитомами (58, 114, 119, 120). Однако в двух других исследованиях был получен плохой результат при множественных кожных мастоцитомах (102, 121).
Роль наличия метастазов в лимфатических узлах тоже остается спорной. В двух исследованиях наличие метастазов было связано с плохим прогнозом (120, 123), однако в другом, у собак с метастазами в лимфатических узлах, была получена длительная продолжительность жизни при проведении облучения (124).
В нескольких исследованиях среднедифференцированных мастоцитом с метастазами в лимфатических узлах, которым проводили удаление лимфоузлов с химиотерапией и облучением, был получен хороший результат (114, 120, 125). При низкодифференцированных мастоцитомах с метастазами в лимфоузлах, медиана продолжительности составила 194 дня, по сравнению с группой без метастазов (503 дня)(84).
Для собак с метастазами мастоцитомы в лимфатическом узле, хирургическое удаление или облучение лимфоузла увеличивает продолжительность жизни.
Таблица 5. ВОЗ классификация стадий мастоцитом
| Стадия | Описание |
|---|---|
| 0 | Одна неполностью отделенная от дермы опухоль, без вовлечения регионарных лимфатических узлов |
| а. Без системных клинических симптомов | |
| b. С клиническими симптомами | |
| I | Одна опухоль связанная с дермой, без вовлечения регионарных лимфатических узлов |
| а. Без системных клинических симптомов | |
| b. С клиническими симптомами | |
| II | Одна опухоль связанная с дермой и вовлечением регионарных лимфатических узлов |
| а. Без системных клинических симптомов | |
| b. С клиническими симптомами | |
| III | Множественные дермальные опухоли, инфильтрирующие опухоли с или без вовлечения регионарных лимфатических узлов |
| а. Без системных клинических симптомов | |
| b. С клиническими симптомами | |
| IV | Любая опухоль с наличием отдаленных метастазов (включая костный мозг и кровь) |
Некоторые породы собак, такие как боксер, мопс и бульдоги, более сколонны к высокодифференцированным мастоцитомам (1, 17, 57, 126).
Недавний быстрый рост опухоли, является плохим прогностическим фактором. Например, в одном исследовании 83% собак с мастоцитомами, растущими в течение 28 недель до операции, имели продолжительность жизни не менее 30 недель, и только 25% собак с образованиями, появившимися менее 28 недель назад (57).
Наличие симптомов гипорексии, рвоты, мелены, диффузной эритемы и отеков, чаще всего связано с системной формой мастоцитомы, которая имеет неблагоприятный прогноз (58, 68, 127). В исследовании собак с висцеральной или системной формой мастоцитомы, была получена короткая продолжительность жизни и все животные погибли от заболевания (69, 70, 128).
Изъязвление, эритема, гнойные истечения из опухоли более характерны для биологически агрессивных образований и связаны с плохим прогнозом по данным ряда исследований (58, 120). Рецидив опухоли после хирургического удаления, также связан с более плохим прогнозом (92, 118, 120, 129).
Диагностика мастоцитом у собак
Диагноз мастоцитомы первично устанавливают по результатам тонкоигольной биопсии, так как опухоль имеет характерные цитоплазматические гранулы и легко диагностируется. Для постановки диагноза некоторых низкодифференцированных мастоцитом может потребоваться иммуногистохимическое исследование (38, 131-133).
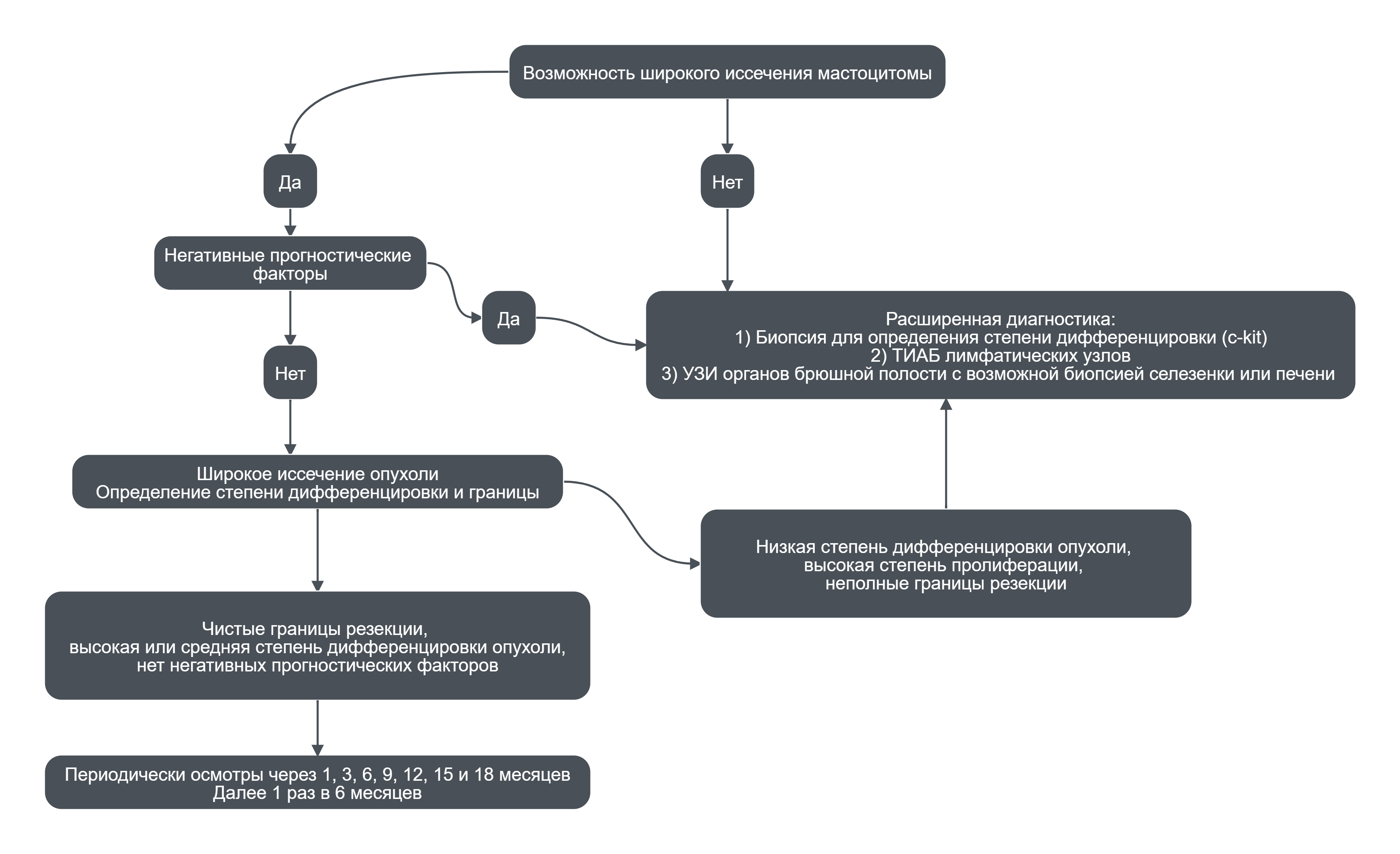
Полноценное предоперационное обследование может включать в себя анализы крови, биопсию лимфатических узлов, селезенки и печени, пункцию красного костного мозга, рентгенографию органов грудной клетки и ультразвуковое исследование органов брюшной полости. Однако для большинства мастоцитом у собак, в такой объемной диагностике нет необходимости. Ниже представлен «классический» алгоритм подхода к собаке с мастоцитомой.
Если расположение мастоцитомы позволяет провести ее широкое иссечение и отсутствуют негативные прогностические факторы, то достаточно провести базовую предоперационную диагностику.
Если опухоль располагается в труднодоступном для широкого иссечения опухоли месте или есть негативные прогностические факторы, по данным анамнеза и клинического осмотра, то рекомендована более тщательная диагностика.
Для определения степени дифференцировки опухоли необходимо провести толстоигольную или инцизионную биопсию. Для оценки лимфатических узлов и органов брюшной полости может потребоваться их тонкоигольная биопсия (134-136).
В нормальных тканях и органах тоже есть мастоциты, что может затруднять интерпретацию результата биопсии, если мастоцитов в образце мало (норма или метастазы). Например, в исследовании 56 здоровых собак породы бигль, примерно в 24% случаев в аспиратах лимфатического узла были найдены мастоциты в небольшом количестве (137). В некоторых случаях для точного понимания стадии заболевания, может потребоваться хирургическое удаление лимфатического узла с его дальнейшим гистологическим исследованием (138).
Ультразвуковое исследование органов брюшной полости является важным диагностическим мероприятием у животных с мастоцитомами из-за их склонности метастазировать в печень или селезенку. В ряде случаев может потребоваться биопсия этих органов. Рентгенография органов грудной клетки может выявить наличие метастазов, однако мастоцитомы редко поражают легкие.
Оценка границ опухоли обычно проводится при клиническом осмотре животного. Для оценки глубины распространения мастоцитомы может потребоваться проведение компьютерной или магнитно-резонансной томографии (142).
Наличие мастоцитов в крови может встречаться при различных состояниях: вирусных инфекциях, воспалительных процессах в коже, регенераторных анемиях, различных новообразованиях и травмах (143-145). В одном исследовании получены выводы о том, что наличие мастоцитов в периферической крови чаще связано не с мастоцитомами (144). Поэтому оценка крови на наличие мастоцитов не является на данный момент рутинным исследованием с целью определить стадию опухолевого процесса.
В другом исследовании на 157 собаках с мастоцитомами, поражение костного мозга на момент первичной диагностики отмечалось только в 2.8% случаев (146). Как правило, при вовлечении в процесс костного мозга, у собаки есть другие признаки системного поражения организма (68). Например, при висцеральной форме мастоцитомы, в 37% случаев обнаруживали мастоциты в периферической крови и в 56% был поражен костный мозг (128). За исключением очень редких случаев лейкемии тучных клеток (147, 148), вовлечение в процесс костного мозга и периферической крови, без поражения лимфатических узлов или органов брюшной полости крайне маловероятно (146).
Лечение мастоцитом у собак и прогноз
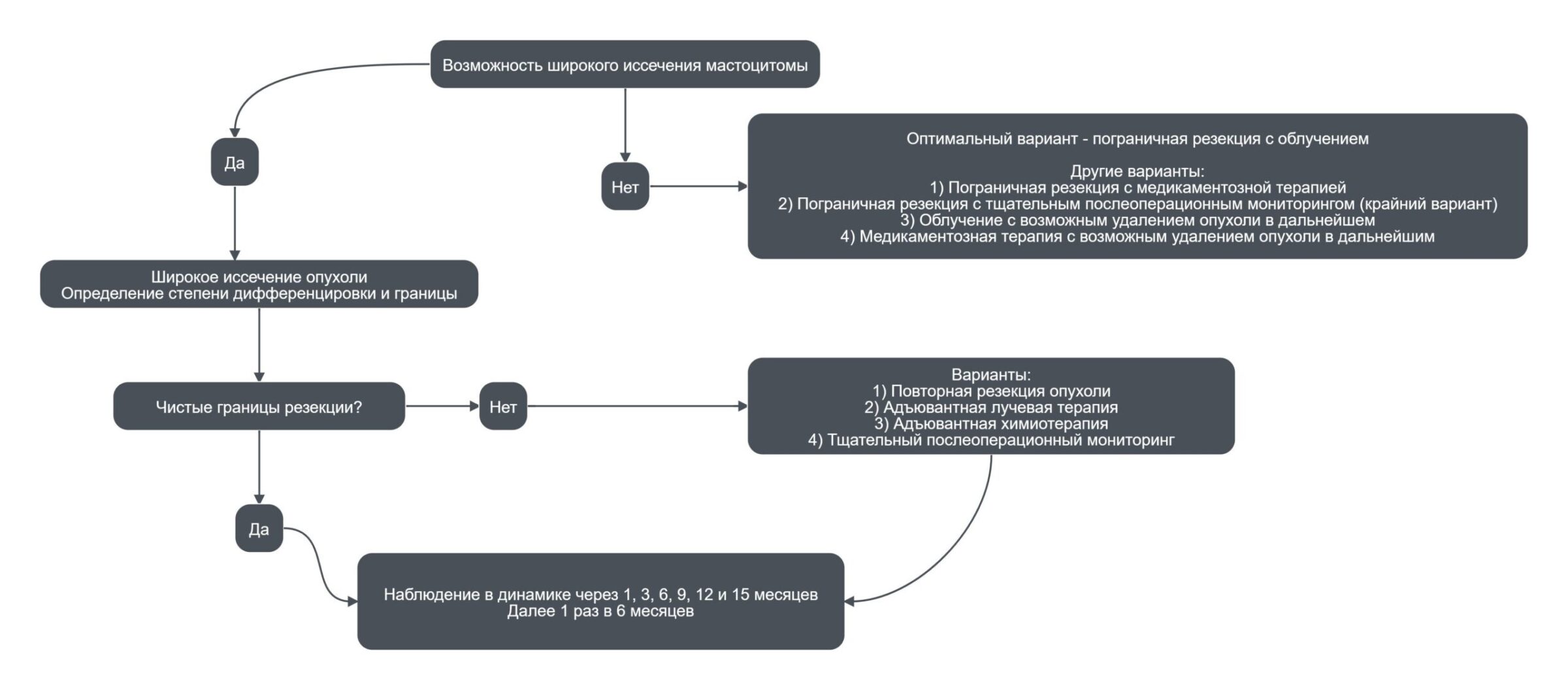
Тактика лечения зависит от наличия негативных прогностических факторов и стадии опухолевого процесса. Если опухоль располагается в удобном для широкого иссечения месте, то операция является оптимальным методом выбора.
Традиционно, рекомендовано удалять опухоль с отступом от видимых границ новообразования 3 см, однако эта рекомендация имеет исторические корни, а не научное обоснование.
В недавних исследованиях, оценивался результат хирургического удаления высоко- и среднедифференцированных мастоцитом менее 5 см в диаметре. В одних исследованиях использовался метрический подход с отступом 1 и 2 см от границ опухоли (149, 150). В другом, применяли пропорциональный подход, при котором отступ от границ опухоли был равен максимальному диаметру новообразования, например от мастоцитомы диаметром 15 мм делали отступ 15 мм (151). При любом из подходов, глубокой границей резекции опухоли, считали удаление одного невовлеченного в процесс фасциального плана (при необходимости удаляли расположенную глубже опухоли мышцу).
У 100 собак с 115 мастоцитомами (высоко- и среднедифференцированные опухоли), не отмечали рецидивов или метастазирования новообразований в течение более 2 летнего периода, с отступом от латеральных границ 10 мм и более, а от глубоких границ 4 мм и более (83). Стоит также учитывать, что при фиксации опухоли в формалине, происходит сокращение тканей (до 30%), что делает отличными границы на момент удаления опухоли и при лабораторной оценке (152-154).
По итогу написанной в абзаце выше информации, можно сделать вывод о том, что большинство высоко- и среднедифференцированных мастоцитом, можно эффективно лечить хирургическим методом при возможности широкого иссечения опухоли. При гистологическом исследовании очень важно оценивать «чистоту» границ резекции.
Если широкое иссечение опухоли невозможно из-за ее размеров, расположения или пожелания владельцев, то проведении биопсии для определения степени дифференцировки мастоцитомы, поможет выбрать оптимальную тактику лечения.
Удаление мастоцитом в области конечностей может быть непростой задачей. Вариантами могут быть (основываясь на степени дифференцировки опухоли): широкое хирургическое иссечение с пластической реконструкцией дефекта или заживлением по вторичному натяжению, ампутация конечности, пограничное удаление опухоли с последующей химиотерапией или облучением. Ампутация конечности является агрессивной и радикальной операцией, однако учитывая наличие других альтернативных и эффективных методов лечения, применяется редко.
Пограничная резекция высоко- и среднедифференцированных мастоцитом с последующей лучевой терапией тоже является адекватным решением. В таких случаях можно рассчитывать на 2ух летнюю выживаемость в 85-95% случаев для высоко и среднедифференцированных мастоцитом 0-I стадии (110, 123, 157-159). Существуют публикации о возможном применении химотерапии при неполных границах резекции опухоли для снижения частоты её рецидивирования (160, 161). Также есть публикации об отсутствии рецидивов, несмотря на грязные границы резекции некоторых высоко и среднедифференцированных мастоцитом, без дополнительной химиотерапии или облучения после операции (162), однако данных подход не является оптимальным.
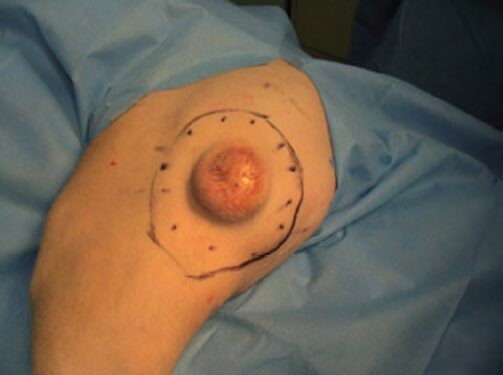
Рисунок 6. Удаление мастоцитомы у собаки с отступом от видимых границ новообразования 3 см.
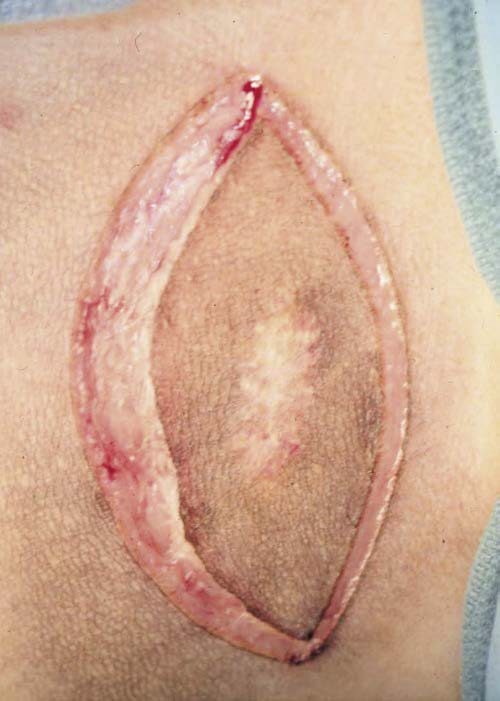
Рисунок 7. Удаление рубца после неполного удаления мастоцитомы у собаки.
В случаях неполного удаления опухоли, рекомендовано проведение дополнительной местной терапии. По возможности проводят повторное удаление послеоперационного рубца и окружающих тканей с повторным гистологическим исследованием (78, 162, 164). Другой альтернативой может быть проведение лучевой терапии места операции. Не все мастоцитомы с «грязными» границами удаления рецидивируют, в некоторых исследованиях они отмечались только в 10-30% случаев (92, 162, 165).
Лечебный алгоритм для высоко и среднедифференцированных мастоцитом 0-I стадии
Описаны альтернативные методы локального лечения мастоцитом у собак: гипертермия в комбинации с облучением (166), внутриопухолевая брахитерапия (167), фотодинамическая терапия (168, 169), внутриопухолевое введение кортикостероидов (170, 171), криотерапия и электрохимитерапия (172-175). Также есть публикации о внутриопухолевом введении деионизированной воды при неполном удаление мастоцитомы, однако результаты исследований говорят о неэффективности метода и на данный момент он рекомендован к применению в клинической практике (176-181).
Лечение биологически агрессивных форм мастоцитомы остается сложной задачей. К агрессивным формам можно отнести: среднедифференцированные опухоли с регионарными или отдаленными метастазами, низкодифференцированные мастоцитомы, мастоцитомы с высокой пролиферативной активностью, мастоцитомы расположенные на слизистых и кожно-слизистых участках.
Есть данные о более благоприятном прогнозе для среднедифференцированных мастоцитом с метастазами в лимфатических узлах, по сравнению с низкодифференцированными опухолями (113, 114).
Лечебный алгоритм при агрессивных формах мастоцитомы у собак представлен ниже.
Лечебный алгоритм для низкодифференцированных и биологически агрессивных мастоцитом
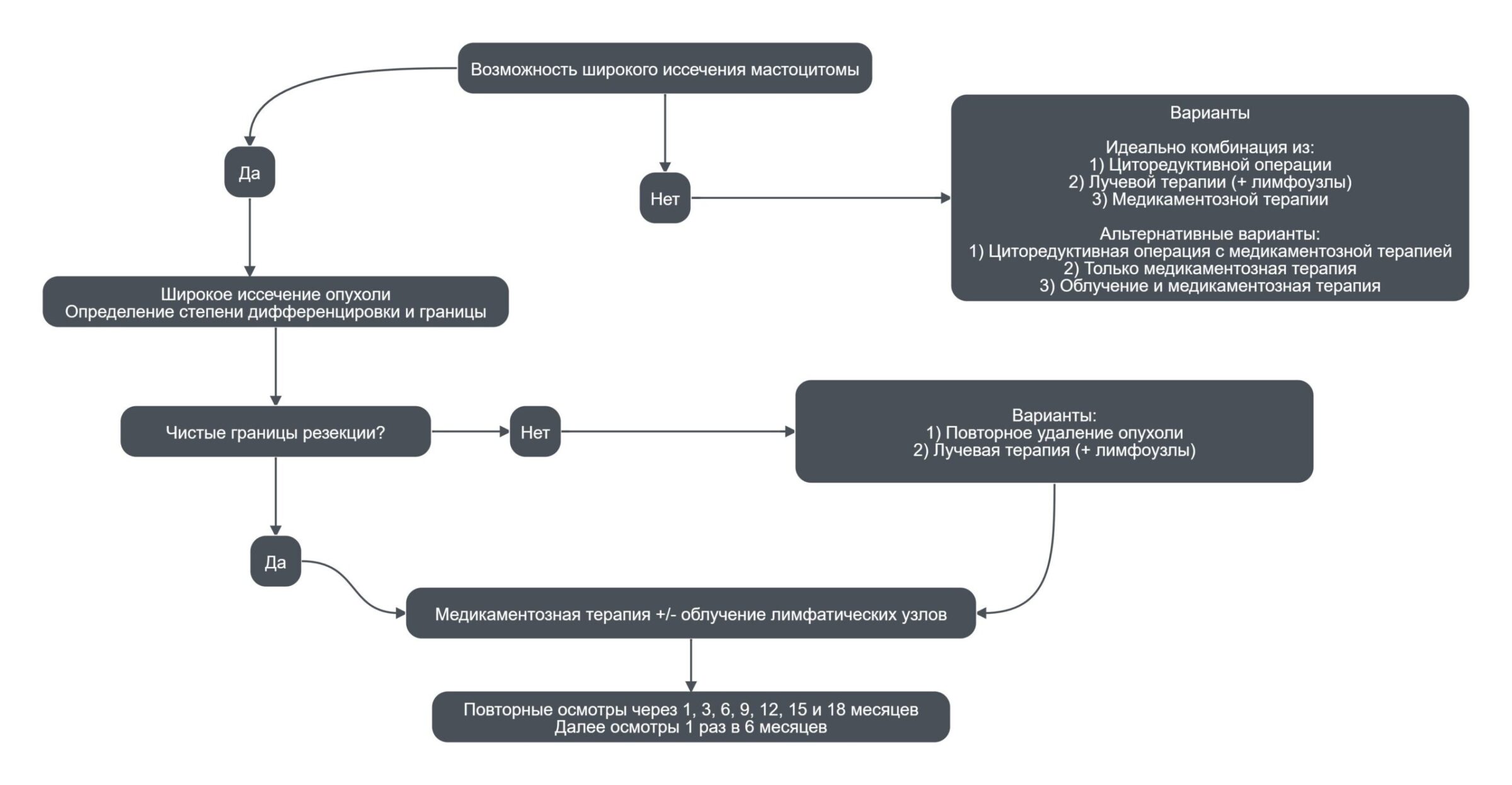
Без эффективной послеоперационной терапии, собаки с низкодифференцированной формой мастоцитомы или наличием метастазов, погибнут от прогрессирования заболевания в организме.
Системная адъювантная терапия помогает продлить безрецидивный период и продолжительность жизни животного. Применение после операции таких кортикостероидов, как преднизолон, имеет определенные плюсы (182-186). Они могут ингибировать пролиферацию и индуцировать апоптоз клеток мастоцитомы in vitro (187), уменьшают перитуморальный отек и воспаление.
Ветеринарная онкологическая группа (VCOG) изучала эффективность применения преднизолона в монорежиме у собак с мастоцитомами средней и низкой степенью дифференцировки (186). В исследовании 21 собака получала преднизолон в дозировке 1 мг/кг в сутки, по результатам исследования только 1 собака полностью ответила на терапию и у 4 животных отмечался частичный ответ, продолжительность жизни была короткой и составила в большинстве случаев несколько недель.
В более свежих исследованиях был получен ответ в 70-75% случаев от приема преднизолона, однако его использовали в качестве предоперационной терапии для уменьшения размера опухоли (185, 188), поэтому длительная эффективность применения препарата неизвестна.
Ответ на терапию кортикостероидами зависит от выраженности экспрессии рецепторов к кортикостероидам у клеток мастоцитомы, чем их больше, тем лучше ответ на препараты (189).
Ниже представленная сводная таблица по эффективности различных медикаментов и протоколов при мастоцитомах у собак (таблица 5). Объективный ответ опухоли достигал 64%, наиболее эффективными оказались протоколы с несколькими препаратами (32, 120, 125, 193, 195, 197).
Важным моментом является тот факт, что в большинстве случаев ответ мастоцитомы на медикаментозную терапию был коротким по продолжительности, что делает крайне важным локальный контроль за опухолью (хирургия, лучевая терапия), помимо системного лечения.
Таблица 5. Эффективность применения различных препаратов у собак с мастоцитомами.
| Препарат | Количество животных | % полного ответа | % частичного ответа | % общего ответа | Медиана длительности ответа | Номер публикации в списке литературы |
|---|---|---|---|---|---|---|
| Преднизолон | 25 | 4 | 16 | 20 | Нет данных | 195 |
| Винкристин | 27 | 0 | 7 | 7 | Нет данных | 198 |
| Ломустин | 21 | 6 | 38 | 44 | 79 суток | 199 |
| Преднизолон и винбластин | 17 | 33 | 13 | 47 | 154 лдня | 128 |
| Преднизолон и винбластин | 28 | 4 | 39 | 43 | Нет данных | 292 |
| Преднизолон/циклофосфамид/винбластин | 11 | 18 | 45 | 63 | 74 дня | 134 |
| Циклофосфамид/винкристин/преднизолон/гидроксиуреа | 17 | 23 | 35 | 59 | 53 дня | 34 |
| Преднизолон/винбластин/ломустин | 37 | 24 | 32 | 57 | 52 недели | 201 |
| Преднизолон/винбластин/ломустин | 17 | 29 | 35 | 64 | 141/66 дней (полный/частичный ответ) | 204 |
| Гидроксиуреа | 46 | 4 | 24 | 28 | 46 дней (частичный ответ) | 200 |
| Преднизолон/хлорамбуцил | 21 | 14 | 24 | 38 | 533 дня | 203 |
| Тоцераниб | 60 | 17 | 46 | 63 | Нет данных | 292 |
| Тоцераниб | 145 | 14 | 28 | 43 | 12 недель | 214 |
| Маситиниб | 39 | 38 | 44 | 82 | Нет данных | 293 |
| Маситиниб | 161 | 26 | 29 | 55 | Нет данных | 216 |
| Тоцераниб/циклофосфамид | 41 | 10 | 36 | 46 | 132 дня (частичный ответ) | 222 |
| Тоцераниб/винбластин | 14 | 14 | 57 | 71 | Нет данных | 224 |
В нескольких исследованиях оценивалась эффективность медикаментозной терапии агрессивных форм мастоцитомы после их хирургического удаления.
В одном исследовании оценивали эффективность применения преднизолона и винбластина у собак с агрессивной формой мастоцитомы (метастазы в лимфатических узлах, локализация на слизистых оболочках, низкая степень дифференцировки). В этом исследовании, собаки с низкодифференцированными мастоцитомами имели медиану продолжительности жизни 1374 дня (114). В другом исследовании была получена 70% 2-ух летняя выживаемость собак с низкодифференцированными мастоцитомами (198).
Комбинацию из преднизолона, ломустина и винбластина использовали для борьбы с оставшимися резидуальными клетками опухоли у собак с высоким риском диссеминации мастоцитомы. В этом исследовании продолжительность жизни животных составила 48 недель (193).
Комбинация из циклофосфамида, винбластина и преднизолона тоже показала обещающие результаты у собак с агрессивной формой мастоцитомы. По результатам исследования продолжительность жизни составила более 2092 суток (125).
В большинстве мастоцитом у собак отмечается экспрессия KIT, в 20-40% определяется мутация рецептора (43, 46, 50, 203). Доступны ветеринарные препараты, которые ингибируют эти рецепторы — ингибиторы тирозинкиназы: тоцераниб (Палладия) и маситиниб (Масивет). Есть также исследования применения медицинского препарата иматиниба (Гливек) на собаках.
Исследование тоцераниба проводилась на собаках с рецидивами или метастазами или низкодифференцированными мастоцитомами (206). В исследовании на 145 собаках, ответ на терапию наблюдался в 42,8% случаев и еще 16 животных отмечалась стабилизация заболевания (206). Среднее время ответа на терапию составило 12 недель. Наличие мутации c-kit значимо увеличивало ответ на терапию (129, 207).
Наиболее частым побочным действием применения тоцераниба является нарушение функции желудочно-кишечного тракта (сниженный аппетит, рвота, диарея, потеря веса, мелена), что требует проведения симптоматической терапии, временной отмены препаратов или снижение дозы. Есть данные о развитие гипертензии от приема препарата, которую купировали применением стандартных гипотензивных средств (эналаприл, амлодипин и другие)(208).
Другие описанные побочные эффекты от приема тоцераниба: лейкопения легкой или средней степени, протеинурия и мышечная боль (206, 208). Более новые исследования свидетельствуют о сохранении аналогичного противоопухолевого эффекта после снижения рекомендуемой производителем дозировки тоцераниба. Дозировку в 2.5-2.75 мг/кг 3 раза в неделю использует множество онкологов (209).
Исследование маситиниба проводилось на собаках с рецидивами или нерезектабельными мастоцитомами (210). Прием препарата позволял стабилизировать опухоль, особенно в случаях наличия мутации c-kit.
В другом исследовании маситиниба, 2-ух годичная выживаемость составила 40% (в контрольной группе только 15%)(211). Из побочных действий чаще всего отмечались нарушения в работе желудочно-кишечного тракта, однако они были минимальные и проходили самостоятельно в большинстве случаев. Миелосупрессия встречалась редко и была средней степени выраженности в большинстве случаев. У небольшого количества собак развилась нефропатия с потерей белка, что проявлялось в виде отеков. Также есть редкие случаи повышения концентрации креатинина и мочевины в крови, развития гемолитической анемии (210).
Иматиниб исследовался на собаках с мастоцитомами (212-214). Препарат хорошо переносился и отмечался объективный ответ на терапию. Однако в этих исследованиях оценивалась фармакокинетика иматиниба, а рекомендованные дозировки основывались на клинических наблюдениях.
Существуют исследования безопасности и эффективности терапии, сочетающей стандартные препараты для химиотерапии в комбинации с ингибиторами тирозинкиназы.
В исследованиях применяли тоцераниб в комбинации с ломустином и винбластином (215-218). В этих исследованиях возникла необходимость снижения дозировки химиопрепаратов для минимизации миелосупрессии.
В исследовании комбинации из тоцераниба, преднизолона и лучевой терапии у собак с нерезектабельными или метастатическими мастоцитомами, частота ответа на терапию достигала 76.4% (58.8% полный ответ и 17.6% частичный ответ)(219). Медиана наблюдения составила 374 дня. Комбинация тоцераниба и лучевой терапии хорошо переносилась и показала свою эффективность в большинстве случаев и может быть рекомендована для лечения нерезектабельных мастоцитом.
Новые медикаментозные протоколы могут открыть более эффективные способы лечения мастоцитомы у собак: ингибиторы JAK2/STAT5 (220), ингибиторы гистондеацетилазы (HDAC)(221-223), ингибиторы HSP90 (224, 225), ретиноиды (226-228), TRAIL (229), ингибиторы поло-подобной киназы-1 (230). В одном исследовании оценивался эффект от применения моноклональных антител к KIT у собак с мастоцитомами и был получен множественный объективный ответ (231).
Иногда возникает необходимость применения препаратов для борьбы с системными проявлениями мастоцитом, связанными с дегрануляцией мастоцитов. Минимизацию действия гистамина получают назначением блокаторов H1 и H2 рецепторов (фамотидин, ранитидин и другие) или блокаторов протонной помпы (омепразол)(232-234).
Список используемой литературы
Полные версии статьей можно найти на сайте — PubMed.
Ниже можно ознакомиться с научными публикациями используемыми при написании данной статьи.
- Bostock DE: Neoplasms of the skin and subcutaneous tissues in dogs and cats, Br Vet J 142:1–19, 1986.
- Carpenter JL, Andrews LK, Holzworth J: Tumors and tumor-like lesions. In Holzworth J, editor: Diseases of the cat: medicine and surgery, Philadelphia, 1987, WB Saunders, pp 406–596.
- Finnie JW, Bostock DE: Skin neoplasia in dogs, Aust Vet J 55:602– 604, 1979.
- Miller MA, Nelson SL, Turk JR, et al.: Cutaneous neoplasia in 340 cats, Vet Pathol 28:389–395, 1991.
- Rothwell TL, Howlett CR, Middleton DJ, et al.: Skin neoplasms of dogs in Sydney, Aust Vet J 64:161–164, 1987.
- Kumar V, Sharma A: Mast cells: emerging sentinel innate immune cells with diverse role in immunity, Mol Immunol 48:14–25, 2010
- Noviana D, Mamba K, Makimura S, et al.: Distribution, histochemical and enzyme histochemical characterization of mast cells in dogs, J Mol Histol 35:123–132, 2004.
- Metz M, Piliponsky AM, Chen CC, et al.: Mast cells can enhance resistance to snake and honeybee venoms, Science 313:526–530, 2006.
- Lin TY, London CA: A functional comparison of canine and murine bone marrow derived cultured mast cells, Vet Immunol Immunopathol 114:320–334, 2006.
- Lin TY, Rush LJ, London CA: Generation and characterization of bone marrow-derived cultured canine mast cells, Vet Immunol Immunopathol 113:37–52, 2006.
- Lin TY, London CA: Characterization and modulation of canine mast cell derived eicosanoids, Vet Immunol Immunopathol 135:118– 127, 2010.
- Brodey RS: Canine and feline neoplasia, Adv Vet Sci Comp Med 14:309–354, 1970.
- Patnaik AK, Ehler WJ, MacEwen EG: Canine cutaneous mast cell tumor: morphologic grading and survival time in 83 dogs, Vet Pathol 21:469–474, 1984.
- Peters JA: Canine mastocytoma: excess risk as related to ancestry, J Natl Cancer Inst 42:435–443, 1969.
- White CR, Hohenhaus AE, Kelsey J, et al.: Cutaneous MCTs: associations with spay/neuter status, breed, body size, and phylogenetic cluster, J Am Anim Hosp Assoc 47:210–216, 2011.
- Arendt ML, Melin M, Tonomura N, et al.: Genome-wide association study of golden retrievers identifies germ-line risk factors predisposing to mast cell tumours, PLoS Genet 11:e1005647, 2015.
- McNiel EA, Prink AL, O’Brien TD: Evaluation of risk and clinical outcome of mast cell tumours in pug dogs, Vet Comp Oncol 4:2–8, 2004.
- Davis BJ, Page R, Sannes PL, et al.: Cutaneous mastocytosis in a dog, Vet Pathol 29:363–365, 1992.
- Dunn TB, Patter H: A transplantable mast cell neoplasm in the mouse, J Natl Cancer Inst 18:587–601, 1957.
- Hottendorf GH, Nielsen SW: Pathologic survey of 300 extirpated canine mastocytomas, Zentralbl Veterinarmed A 14:272–281, 1967.
- Peterson SL: Scar-associated canine mast cell tumor, Canine Pract 12:23–29, 1985.
- Bowles CA, Kerber WT, Rangan SRS, et al.: Characterization of a transplantable, canine, immature mast cell tumor, Cancer Res 32:1434–1441, 1972.
- Lombard LS, Moloney JB: Experimental transmission of mast cell sarcoma in dogs, Fed Proc 18:490–495, 1959.
- Nielson SW, Cole CR: Homologous transplantation of canine neoplasms, Am J Vet Res 27:663–672, 1961.
- Stone JM, Jacky PB, Prieur DJ: Chromosomal fragile site expression in boxer dogs with mast cell tumors, Am J Med Genetics 40:223–229, 1991.
- Ginn PE, Fox LE, Brower JC, et al.: Immunohistochemical detection of p53 tumor-suppressor protein is a poor indicator of prognosis for canine cutaneous mast cell tumors, Vet Pathol 37:33–39, 2000.
- Jaffe MH, Hosgood G, Taylor HW, et al.: Immunohistochemical and clinical evaluation of p53 in canine cutaneous mast cell tumors, Vet Pathol 37:40–46, 2000.
- Ozaki K, Yamagami T, Nomura K, et al.: Mast cell tumors of the gastrointestinal tract in 39 dogs, Vet Pathol 39:557–564, 2002.
- Mayr B, Reifinger M, Brem G, et al.: Cytogenetic, ras, and p53: studies in cases of canine neoplasms (hemangiopericytoma, mastocytoma, histiocytoma, chloroma), J Hered 90:124–128, 1999.
- Wu H, Hayashi T, Inoue M: Immunohistochemical expression of p27 and p21 in canine cutaneous mast cell tumors and histiocytomas, Vet Pathol 41:296–299, 2004.
- Elling H, Ungemach FR: Sexual hormone receptors in canine mast cell tumour cytosol, J Comp Pathol 92:629–630, 1982.
- Gerritsen RJ, Teske E, Kraus JS, et al.: Multi-agent chemotherapy for mast cell tumours in the dog, Vet Q 20:28–31, 1998.
- Da Silva L, Fonseca-Alves CE, Thompson JJ, et al.: Pilot assessment of vascular endothelial growth factor receptors and trafficking pathways in recurrent and metastatic canine subcutaneous mast cell tumours, Vet Med Sci 3:146–155, 2017.
- Thompson JJ, Morrison JA, Pearl DL, et al.: Receptor tyrosine kinase expression profiles in canine cutaneous and subcutaneous mast cell tumors, Vet Pathol 53:545–558, 2016.
- Galli SJ, Zsebo KM, Geissler EN: The kit ligand, stem cell factor, Adv Immunol 55:1–95, 1994.
- Roskoski Jr R: Structure and regulation of Kit protein-tyrosine kinase—the stem cell factor receptor, Biochem Biophys Res Commun 338:1307 1315, 2005.
- Roskoski Jr R: Signaling by Kit protein-tyrosine kinase—the stem cell factor receptor, Biochem Biophys Res Commun 337:1–13, 2005.
- Kiupel M, Webster JD, Kaneene JB, et al.: The use of KIT and tryptase expression patterns as prognostic tools for canine cutaneous mast cell tumors, Vet Pathol 41:371–377, 2004.
- London CA, Kisseberth WC, Galli SJ, et al.: Expression of stem cell factor receptor (c-kit) by the malignant mast cells from spontaneous canine mast cell tumours, J Comp Pathol 115:399–414, 1996.
- Morini M, Bettini G, Preziosi R, et al.: C-kit gene product (CD117) immunoreactivity in canine and feline paraffin sections, J Histochem Cytochem 52:705–708, 2004.
- Reguera MJ, Rabanal RM, Puigdemont A, et al.: Canine mast cell tumors express stem cell factor receptor, Am J Dermatopathol 22:49–54, 2000.
- Halsey CHC, Thamm DH, Weishaar KM, et al.: Expression of phosphorylated KIT in canine mast cell tumor, Vet Pathol 54:387– 394, 2017.
- Downing S, Chien MB, Kass PH, et al.: Prevalence and importance of internal tandem duplications in exons 11 and 12 of c-kit in mast cell tumors of dogs, Am J Vet Res 63:1718–1723, 2002.
- Jones CL, Grahn RA, Chien MB, et al.: Detection of c-kit mutations in canine mast cell tumors using fluorescent polyacrylamide gel electrophoresis, J Vet Diagn Invest 16:95–100, 2004.
- Letard S, Yang Y, Hanssens K, et al.: Gain-of-function mutations in the extracellular domain of KIT are common in canine mast cell tumors, Mol Cancer Res 6:1137–1145, 2008.
- London CA, Galli SJ, Yuuki T, et al.: Spontaneous canine mast cell tumors express tandem duplications in the proto-oncogene c-kit, Exp Hematol 27:689–697, 1999.
- London CA, Hannah AL, Zadovoskaya R, et al.: Phase I dose-escalating study of SU11654, a small molecule receptor tyrosine kinase inhibitor, in dogs with spontaneous malignancies, Clin Cancer Res 9:2755–2768, 2003.
- Webster JD, Yuzbasiyan-Gurkan V, Kaneene JB, et al.: The role of c-KIT in tumorigenesis: evaluation in canine cutaneous mast cell tumors, Neoplasia 8:104–111, 2006.
- Webster JD, Yuzbasiyan-Gurkan V, Thamm DH, et al.: Evaluation of prognostic markers for canine mast cell tumors treated with vinblastine and prednisone, BMC Vet Res 4:32, 2008.
- Zemke D, Yamini B, Yuzbasiyan-Gurkan V: Mutations in the juxtamembrane domain of c-KIT are associated with higher grade mast cell tumors in dogs, Vet Pathol 39:529–535, 2002.
- Jark PC, Mundin DB, de Carvalho M, et al.: Genomic copy number variation associated with clinical outcome in canine cutaneous mast cell tumors, Res Vet Sci 111:26–30, 2017.
- Mochizuki H, Thomas R, Moroff S, et al.: Genomic profiling of canine mast cell tumors identifies DNA copy number aberrations associated with KIT mutations and high histological grade, Chromosome Res 25:129–143, 2017.
- Giantin M, Baratto C, Marconato L, et al.: Transcriptomic analysis identified up-regulation of a solute carrier transporter and UDP glucuronosyltransferases in dogs with aggressive cutaneous mast cell tumours, Vet J 212:36–43, 2016.
- Giantin M, Granato A, Baratto C, et al.: Global gene expression analysis of canine cutaneous mast cell tumor: could molecular profiling be useful for subtype classification and prognostication? PLoS One 9:e95481, 2014.
- Schlieben P, Meyer A, Weise C, et al.: Differences in the proteome of high-grade versus low-grade canine cutaneous mast cell tumours, Vet J 194:210–214, 2012.
- Fenger JM, Bear MD, Volinia S, et al.: Overexpression of miR-9 in mast cells is associated with invasive behavior and spontaneous metastasis, BMC Cancer 14:84, 2014.
- Bostock DE: The prognosis following surgical removal of mastocytomas in dogs, J Small Anim Pract 14:27–41, 1973.
- Mullins MN, Dernell WS, Withrow SJ, et al.: Evaluation of prognostic factors associated with outcome in dogs with multiple cutaneous mast cell tumors treated with surgery with and without adjuvant treatment: 54 cases (1998-2004), J Am Vet Med Assoc 228:91–95, 2006.
- Van Pelt DR, Fowler JD, Leighton FA: Multiple cutaneous mast cell tumors in a dog: a case report and brief review, Can Vet J 27:259–263, 1986.
- Cohen D, Reif SS, Brodey RS: Epidemiological analysis of the most prevalent sites and types of canine neoplasia observed in a veterinary hospital, Cancer Res 34:2859–2868, 1974.
- Crowe DT, Goodwin MA, Greene CE: Total laryngectomy for laryngeal mast cell tumor in a dog, J Am Anim Hosp Assoc 22:809– 816, 1986.
- Iwata N, Ochiai K, Kadosawa T, et al.: Canine extracutaneous mast-cell tumours consisting of connective tissue mast cells, J Comp Pathol 123:306–310, 2000.
- Patnaik AK, MacEwen EG, Black AP, et al.: Extracutaneous mastcell tumor in the dog, Vet Pathol 19:608–615, 1982.
- Steffey M, Rassnick KM, Porter B, et al.: Ureteral mast cell tumor in a dog, J Am Anim Hosp Assoc 40:82–85, 2004.
- Moore TW, Bentley RT, Moore SA, et al.: Spinal mast cell tumors in dogs: imaging features and clinical outcome of four cases, Vet Radiol Ultrasound 58:44–52, 2017.
- Davies AP, Hayden DW, Klausner JS, et al.: Noncutaneous systemic mastocytosis and mast cell leukemia in a dog: case report and literature review, J Am An Hosp Assoc 17:361–368, 1981.
- Takahashi T, Kadosawa T, Nagase M, et al.: Visceral mast cell tumors in dogs: 10 cases (1982-1997), J Am Vet Med Assoc 216:222–226, 2000.
- O’Keefe DA, Couto CG, Burke-Schwartz C, et al.: Systemic mastocytosis in 16 dogs, J Vet Intern Med 1:75–80, 1987.
- Moirano SJ, Lima SF, Hume KR, et al.: Association of prognostic features and treatment on survival time of dogs with systemic mastocytosis: a retrospective analysis of 40 dogs, Vet Comp Oncol 16:E194–E201, 2018.
- Pizzoni S, Sabattini S, Stefanello D, et al.: Features and prognostic impact of distant metastases in 45 dogs with de novo stage IV cutaneous mast cell tumours: a prospective study, Vet Comp Oncol 16:28–36, 2018.
- Tams TR, Macy DW: Canine mast cell tumors, Comp Cont Ed Pract Vet 27:259–263, 1981.
- Fox LE, Rosenthal RC, Twedt DC, et al.: Plasma histamine and gastrin concentrations in 17 dogs with mast cell tumors, J Vet Intern Med 4:242–246, 1990.
- Howard EB, Sawa TR, Nielsen SW, et al.: Mastocytoma and gastroduodenal ulceration. Gastric and duodenal ulcers in dogs with mastocytoma, Pathol Vet 6:146–158, 1969.
- Ishiguro T, Kadosawa T, Takagi S, et al.: Relationship of disease progression and plasma histamine concentrations in 11 dogs with mast cell tumors, J Vet Intern Med 17:194–198, 2003.
- Roberts II LJ, Sweetman BJ, Lewis RA, et al.: Increased production of prostaglandin D2 in patients with systemic mastocytosis, N Engl J Med 303:1400–1484, 1980.
- Scott HW, Parris WCV, Sandidge PC, et al.: Hazards in operative management of patients with systemic mastocytosis, Ann Surg 197:507–514, 1983.
- Hottendorf GH, Nielsen SW, Kenyon AJ: Canine mastocytoma: I. Blood coagulation time in dogs with mastocytoma, Pathol Vet 2:129–141, 1965.
- Murphy S, Sparkes AH, Smith KC, et al.: Relationships between the histological grade of cutaneous mast cell tumours in dogs, their survival and the efficacy of surgical resection, Vet Rec 154:743–746, 2004.
- Simoes JP, Schoning P, Butine M: Prognosis of canine mast cell tumors: a comparison of three methods, Vet Pathol 31:637–647, 1994.
- Michels GM, Knapp DW, DeNicola DB, et al.: Prognosis following surgical excision of canine cutaneous mast cell tumors with histopathologically tumor-free versus nontumor-free margins: a retrospective study of 31 cases, J Am Anim Hosp Assoc 38:458–466, 2002.
- Seguin B, Leibman NF, Bregazzi VS, et al.: Clinical outcome of dogs with grade-II mast cell tumors treated with surgery alone: 55 cases (1996-1999), J Am Vet Med Assoc 218:1120–1123, 2001.
- Weisse C, Shofer FS, Sorenmo K: Recurrence rates and sites for grade II canine cutaneous mast cell tumors following complete surgical excision, J Am Anim Hosp Assoc 38:71–73, 2002.
- Schultheiss PC, Gardiner DW, Rao S, et al.: Association of histologic tumor characteristics and size of surgical margins with clinical outcome after surgical removal of cutaneous mast cell tumors in dogs, J Am Vet Med Assoc 238:1464–1469, 2011.
- Hume CT, Kiupel M, Rigatti L, et al.: Outcomes of dogs with grade 3 mast cell tumors: 43 cases (1997-2007), J Am Anim Hosp Assoc 47:37–44, 2011.
- Northrup NC, Harmon BG, Gieger TL, et al.: Variation among pathologists in histologic grading of canine cutaneous mast cell tumors, J Vet Diagn Invest 17:245–248, 2005.
- Northrup NC, Howerth EW, Harmon BG, et al.: Variation among pathologists in the histologic grading of canine cutaneous mast cell tumors with uniform use of a single grading reference, J Vet Diagn Invest 17:561–564, 2005.
- Kiupel M, Webster JD, Bailey KL, et al.: Proposal of a 2-tier histologic grading system for canine cutaneous mast cell tumors to more accurately predict biological behavior, Vet Pathol 48:147–155, 2011.
- Sabattini S, Scarpa F, Berlato D, et al.: Histologic grading of canine mast cell tumor: is 2 better than 3? Vet Pathol 52:70–73, 2015.
- Preziosi R, Sarli G, Paltrinieri M: Prognostic value of intratumoral vessel density in cutaneous mast cell tumors of the dog, J Comp Pathol 130:143–151, 2004.
- Abadie JJ, Amardeilh MA, Delverdier ME: Immunohistochemical detection of proliferating cell nuclear antigen and Ki-67 in mast cell tumors from dogs, J Am Vet Med Assoc 215:1629–1634, 1999.
- Scase TJ, Edwards D, Miller J, et al.: Canine mast cell tumors: correlation of apoptosis and proliferation markers with prognosis, J Vet Intern Med 20:151–158, 2006.
- Seguin B, Besancon MF, McCallan JL, et al.: Recurrence rate, clinical outcome, and cellular proliferation indices as prognostic indicators after incomplete surgical excision of cutaneous grade II mast cell tumors: 28 dogs (1994-2002), J Vet Intern Med 20:933–940, 2006
- Webster JD, Yuzbasiyan-Gurkan V, Miller RA, et al.: Cellular proliferation in canine cutaneous mast cell tumors: associations with c-KIT and its role in prognostication, Vet Pathol 44:298–308, 2007.
- Maglennon GA, Murphy S, Adams V, et al.: Association of Ki67 index with prognosis for intermediate-grade canine cutaneous mast cell tumours, Vet Comp Oncol 6:268–274, 2008.
- Ozaki K, Yamagami T, Nomura K, et al.: Prognostic significance of surgical margin, Ki-67 and cyclin D1 protein expression in grade II canine cutaneous mast cell tumor, J Vet Med Sci 69:1117–1121, 2007.
- Sakai H, Noda A, Shirai N, et al.: Proliferative activity of canine mast cell tumours evaluated by bromodeoxyuridine incorporation and Ki-67 expression, J Comp Pathol 127:233–238, 2002.
- Thompson JJ, Yager JA, Best SJ, et al.: Canine subcutaneous mast cell tumors: cellular proliferation and KIT expression as prognostic indices, Vet Pathol 48:169–181, 2011.
- Bostock DE, Crocker J, Harris K, et al.: Nucleolar organiser regions as indicators of post-surgical prognosis in canine spontaneous mast cell tumours, Br J Cancer 59:915–918, 1989.
- Kravis LD, Vail DM, Kisseberth WC, et al.: Frequency of argyrophilic nucleolar organizer regions in fine-needle aspirates and biopsy specimens from mast cell tumors in dogs, J Am Vet Med Assoc 209:1418–1420, 1996.
- Romansik EM, Reilly CM, Kass PH, et al.: Mitotic index is predictive for survival for canine cutaneous mast cell tumors, Vet Pathol 44:335–341, 2007.
- Elston L, Sueiro FA, Cavalcanti J, et al.: The importance of the mitotic index as a prognostic factor for canine cutaneous mast cell tumors — a validation study, Vet Pathol 46:362–365, 2009.
- Preziosi R, Sarli G, Paltrinieri M: Multivariate survival analysis of histological parameters and clinical presentation in canine cutaneous mast cell tumours, Vet Res Commun 31:287–296, 2007.
- Thompson JJ, Pearl DL, Yager JA, et al.: Canine subcutaneous mast cell tumor: characterization and prognostic indices, Vet Pathol 48:156–168, 2011.
- Ayl RD, Couto CG, Hammer AS, et al.: Correlation of DNA ploidy to tumor histologic grade, clinical variables, and survival in dogs with mast cell tumors, Vet Pathol 29:386–390, 1992.
- Patruno R, Arpaia N, Gadaleta CD, et al.: VEGF concentration from plasma-activated platelets rich correlates with microvascular density and grading in canine mast cell tumour spontaneous model, J Cell Mol Med 13:555–561, 2009.
- Strefezzi Rde F, Xavier JG, Catao-Dias JL: Morphometry of canine cutaneous mast cell tumors, Vet Pathol 40:268–275, 2003.
- Strefezzi Rde F, Xavier JG, Kleeb SR, et al.: Nuclear morphometry in cytopathology: a prognostic indicator for canine cutaneous mast cell tumors, J Vet Diagn Invest 21:821–825, 2009.
- Webster JD, Kiupel M, Kaneene JB, et al.: The use of KIT and tryptase expression patterns as prognostic tools for canine cutaneous mast cell tumors, Vet Pathol 41:371–377, 2004.
- Bergman PJ, Craft DM, Newman SJ, et al.: Correlation of histologic grading of canine mast cell tumors with Ki67/PCNA/ AgNOR/c-Kit scores: 38 cases (2002-2003), Vet Comp Oncol 2: 98–98, 2004.
- Turrel JM, Kitchell BE, Miller LM, et al.: Prognostic factors for radiation treatment of mast cell tumor in 85 dogs, J Am Vet Med Assoc 193:936–940, 1988.
- Cahalane AK, Payne S, Barber LG, et al.: Prognostic factors for survival of dogs with inguinal and perineal mast cell tumors treated surgically with or without adjunctive treatment: 68 cases (1994- 2002), J Am Vet Med Assoc 225:401–408, 2004.
- Sfiligoi G, Rassnick KM, Scarlett JM, et al.: Outcome of dogs with mast cell tumors in the inguinal or perineal region versus other cutaneous locations: 124 cases (1990-2001), J Am Vet Med Assoc 226:1368–1374, 2005.
- Hillman LA, Garrett LD, de Lorimier LP, et al.: Biological behavior of oral and perioral mast cell tumors in dogs: 44 cases (1996- 2006), J Am Vet Med Assoc 237:936–942, 2010.
- Thamm DH, Turek MM, Vail DM: Outcome and prognostic factors following adjuvant prednisone/vinblastine chemotherapy for high-risk canine mast cell tumour: 61 cases, J Vet Med Sci 68:581– 587, 2006.
- Gieger TL, Theon AP, Werner JA, et al.: Biologic behavior and prognostic factors for mast cell tumors of the canine muzzle: 24 cases (1990-2001), J Vet Intern Med 17:687–692, 2003.
- Fife M, Blocker T, Fife T, et al.: Canine conjunctival mast cell tumors: a retrospective study, Vet Ophthalmol 14:153–160, 2011.
- Krick EL, Billings AP, Shofer FS, et al.: Cytological lymph node evaluation in dogs with mast cell tumours: association with grade and survival, Vet Comp Oncol 7:130–138, 2009.
- Horta RS, Lavalle GE, Monteiro LN, et al.: Assessment of canine mast cell tumor mortality risk based on clinical, histologic, immunohistochemical, and molecular features, Vet Pathol 55:212–223, 2018.
- Murphy S, Sparkes AH, Blunden AS, et al.: Effects of stage and number of tumours on prognosis of dogs with cutaneous mast cell tumours, Vet Rec 158:287–291, 2006.
- Thamm DH, Mauldin EA, Vail DM: Prednisone and vinblastine chemotherapy for canine mast cell tumor—41 cases (1992-1997), J Vet Intern Med 13:491–497, 1999.
- Kiupel M, Webster JD, Miller RA, et al.: Impact of tumour depth, tumour location and multiple synchronous masses on the prognosis of canine cutaneous mast cell tumours, J Vet Med A Physiol Pathol Clin Med 52:280–286, 2005.
- Zavodovskaya R, Chien MB, London CA: Use of kit internal tandem duplications to establish mast cell tumor clonality in 2 dogs, J Vet Intern Med 18:915–917, 2004.
- LaDue T, Price GS, Dodge R, et al.: Radiation therapy for incompletely resected canine mast cell tumors, Vet Radiol Ultrasound 39:57–62, 1998.
- Chaffin K, Thrall DE: Results of radiation therapy in 19 dogs with cutaneous mast cell tumor and regional lymph node metastasis, Vet Radiol Ultrasound 43:392–395, 2002.
- Camps-Palau MA, Leibman NF, Elmslie R, et al.: Treatment of canine mast cell tumours with vinblastine, cyclophosphamide and prednisone: 35 cases (1997-2004), Vet Comp Oncol 5:156–167, 2007.
- Mochizuki H, Motsinger-Reif A, Bettini C, et al.: Association of breed and histopathological grade in canine mast cell tumours, Vet Comp Oncol 15:829–839, 2017.
- Pollack MJ, Flanders JA, Johnson RC: Disseminated malignant mastocytoma in a dog, J Am Anim Hosp Assoc 27:435–440, 1991.
- O’Keefe DA: Canine mast cell tumors, Vet Clin North Amer — Sm Anim Pract 20:1105–1115, 1990.
- Horta RDS, Giuliano A, Lavalle GE, et al.: Clinical, histological, immunohistochemical and genetic factors associated with measurable response of high-risk canine mast cell tumours to tyrosine kinase inhibitors, Oncol Lett 15:129–136, 2018.
- Clinkenbeard KD: Diagnostic cytology: mast cell tumors, Comp Cont Ed Pract Vet 13:1697–1704, 1991.
- Mederle O, Mederle N, Bocan EV, et al.: VEGF expression in dog mastocytoma, Rev Med Chir Soc Med Nat Iasi 114:185–188, 2010.
- Rabanal RH, Fondevila DM, Montane V, et al.: Immunocytochemical diagnosis of skin tumours of the dog with special reference to undifferentiated types, Res Vet Sci 47:129–133, 1989.
- Sandusky GE, Carlton WW, Wightman KA: Diagnostic immunohistochemistry of canine round cell tumors, Vet Pathol 24:495– 499, 1987.
- Camus MS, Priest HL, Koehler JW, et al.: Cytologic criteria for mast cell tumor grading in dogs with evaluation of clinical outcome, Vet Pathol 53:1117–1123, 2016.
- Hergt F, von Bomhard W, Kent MS, et al.: Use of a 2-tier histologic grading system for canine cutaneous mast cell tumors on cytology specimens, Vet Clin Pathol 45:477–483, 2016.
- Scarpa F, Sabattini S, Bettini G: Cytological grading of canine cutaneous mast cell tumours, Vet Comp Oncol 14:245–251, 2016.
- Bookbinder PF, Butt MT, Harvey HJ: Determination of the number of mast cells in lymph node, bone marrow, and buffy coat cytologic specimens from dogs, J Am Vet Med Assoc 200:1648–1650, 1992.
- Weishaar KM, Thamm DH, Worley DR, et al.: Correlation of nodal mast cells with clinical outcome in dogs with mast cell tumour and a proposed classification system for the evaluation of node metastasis, J Comp Pathol 151:329–338, 2014.
- Sato AF, Solano M: Ultrasonographic findings in abdominal mast cell disease: a retrospective study of 19 patients, Vet Radiol Ultrasound 45:51–57, 2004.
- Stefanello D, Valenti P, Faverzani S, et al.: Ultrasound-guided cytology of spleen and liver: a prognostic tool in canine cutaneous mast cell tumor, J Vet Intern Med 23:1051–1057, 2009.
- Book AP, Fidel J, Wills T, et al.: Correlation of ultrasound findings, liver and spleen cytology, and prognosis in the clinical staging of high metastatic risk canine mast cell tumors, Vet Radiol Ultrasound 52:548–554, 2011.
- Hahn KA, Lantz GC, Salisbury SK: Comparison of survey radiography with ultrasonography and X-ray computed tomography for clinical staging of subcutaneous neoplasms in dogs, J Am Vet Med Assoc 196:1795–1798, 1990.
- Cayatte SM, McManus PM, Miller WH, et al.: Identification of mast cells in buffy coat preparations from dogs with inflammatory skin diseases, J Am Vet Med Assoc 206:325–326, 1995.
- McManus PM: Frequency and severity of mastocytemia in dogs with and without mast cell tumors: 120 cases (1995-1997), J Am Vet Med Assoc 215:355–357, 1999.
- Stockham SL, Basel DL, Schmidt DA: Mastocytemia in dogs with acute inflammatory diseases, Vet Clin Pathol 15:16–21, 1986.
- Endicott MM, Charney SC, McKnight JA, et al.: Clinicopathological findings and results of bone marrow aspiration in dogs with cutaneous mast cell tumours: 157 cases (1999-2002), Vet Comp Oncol 5:31–37, 2007.
- Plier ML, MacWilliams PS: Systemic mastocytosis and mast cell leukemia. In Feldman BF, Zinkl JG, Jain NC, editors: Schalm’s veterinary hematology, ed 5, Philadelphia, 2000, Lippincott Williams & Wilkins, pp 747–754.
- Hikasa Y, Morita T, Futaoka Y, et al.: Connective tissue-type mast cell leukemia in a dog, J Vet Med Sci 62:187–190, 2000.
- Simpson AM, Ludwig LL, Newman SJ, et al.: Evaluation of surgical margins required for complete excision of cutaneous mast cell tumors in dogs, J Am Vet Med Assoc 224:236–240, 2004.
- Fulcher RP, Ludwig LL, Bergman PJ, et al.: Evaluation of a two-centimeter lateral surgical margin for excision of grade I and grade II cutaneous mast cell tumors in dogs, J Am Vet Med Assoc 228:210–215, 2006.
- Pratschke KM, Atherton MJ, Sillito JA, et al.: Evaluation of a modified proportional margins approach for surgical resection of mast cell tumors in dogs: 40 cases (2008-2012), J Am Vet Med Assoc 243:1436–1441, 2013.
- Johnson RE, Sigman JD, Funk GF, et al.: Quantification of surgical margin shrinkage in the oral cavity, Head Neck 19:281–286, 1997.
- Kerns MJ, Darst MA, Olsen TG, et al.: Shrinkage of cutaneous specimens: formalin or other factors involved? J Cutan Pathol 35:1093–1096, 2008.
- Reimer SB, Seguin B, DeCock HE, et al.: Evaluation of the effect of routine histologic processing on the size of skin samples obtained from dogs, Am J Vet Res 66:500–505, 2005.
- Shaw T, Kudnig ST, Firestone SM: Diagnostic accuracy of pretreatment biopsy for grading cutaneous mast cell tumours in dogs, Vet Comp Oncol 16:214–219, 2018.
- Prpich CY, Santamaria AC, Simcock JO, et al.: Second intention healing after wide local excision of soft tissue sarcomas in the distal aspects of the limbs in dogs: 31 cases (2005-2012), J Am Vet Med Assoc 244:187–194, 2014.
- al-Sarraf R, Mauldin GN, Patnaik AK, et al.: A prospective study of radiation therapy for the treatment of grade 2 mast cell tumors in 32 dogs, J Vet Intern Med 10:376–378, 1996.
- Frimberger AE, Moore AS, LaRue SM, et al.: Radiotherapy of incompletely resected, moderately differentiated mast cell tumors in the dog: 37 cases (1989-1993), J Am Anim Hosp Assoc 33:320– 324, 1997.
- Poirier VJ, Adams WM, Forrest LJ, et al.: Radiation therapy for incompletely excised grade II canine mast cell tumors, J Am Anim Hosp Assoc 42:430–434, 2006.
- Hosoya K, Kisseberth WC, Alvarez FJ, et al.: Adjuvant CCNU (lomustine) and prednisone chemotherapy for dogs with incompletely excised grade 2 mast cell tumors, J Am Anim Hosp Assoc 45:14–18, 2009.
- Davies DR, Wyatt KM, Jardine JE, et al.: Vinblastine and prednisolone as adjunctive therapy for canine cutaneous mast cell tumors, J Am Anim Hosp Assoc 40:124–130, 2004.
- Vincenti S, Findji F: Influence of treatment on the outcome of dogs with incompletely excised grade-2 mast cell tumors, Schweiz Arch Tierheilkd 159:171–177, 2017.
- Hahn KA, King GK, Carreras JK: Efficacy of radiation therapy for incompletely resected grade-III mast cell tumors in dogs: 31 cases (1987-1998), J Am Vet Med Assoc 224:79–82, 2004.
- Kry KL, Boston SE: Additional local therapy with primary re-excision or radiation therapy improves survival and local control after incomplete or close surgical excision of mast cell tumors in dogs, Vet Surg 43:182–189, 2014.
- Misdorp W: Incomplete surgery, local immunostimulation, and recurrence of some tumour types in dogs and cats, Vet Q 9:279– 286, 1987.
- Lagoretta RA, Denman DL, Kelley MC, et al.: Use of hyperthermia and radiotherapy in treatment of a large mast cell sarcoma in a dog, J Am Vet Med Assoc 193:1545–1548, 1988.
- Northrup NC, Roberts RE, Harrell TW, et al.: Iridium-192 interstitial brachytherapy as adjunctive treatment for canine cutaneous mast cell tumors, J Am Anim Hosp Assoc 40:309–315, 2004.
- Frimberger AE, Moore AS, Cincotta L, et al.: Photodynamic therapy of naturally occurring tumors in animals using a novel benzophenothiazine photosensitizer, Clin Cancer Res 4:2207–2218, 1998.
- Tanabe S, Yamaguchi M, Iijima M, et al.: Fluorescence detection of a new photosensitizer, PAD-S31, in tumour tissues and its use as a photodynamic treatment for skin tumours in dogs and a cat: a preliminary report, Vet J 167:286–293, 2004.
- Rogers KS: Common questions about diagnosing and treating canine mast cell tumors, Vet Med 88:246–250, 1993.
- Case A, Burgess K: Safety and efficacy of intralesional triamcinolone administration for treatment of mast cell tumors in dogs: 23 cases (2005-2011), J Am Vet Med Assoc 252:84–91, 2018.
- Spugnini EP, Vincenzi B, Baldi F, et al.: Adjuvant electrochemotherapy for the treatment of incompletely resected canine mast cell tumors, Anticancer Res 26:4585–4589, 2006.
- Spugnini EP, Vincenzi B, Citro G, et al.: Evaluation of cisplatin as an electrochemotherapy agent for the treatment of incompletely excised mast cell tumors in dogs, J Vet Intern Med 25:407–411, 2011.
- Kodre V, Cemazar M, Pecar J, et al.: Electrochemotherapy compared to surgery for treatment of canine mast cell tumours, In Vivo 23:55–62, 2009.
- Lowe R, Gavazza A, Impellizeri JA, et al.: The treatment of canine mast cell tumors with electrochemotherapy with or without surgical excision, Vet Comp Oncol 15:775–784, 2017.
- Neyens IJ, Kirpensteijn J, Grinwis GC, et al.: Pilot study of intraregional deionised water adjunct therapy for mast cell tumours in dogs, Vet Rec 154:90–91, 2004.
- Grier RL, Di Guardo G, Schaffer CB, et al.: Mast cell tumor destruction by deionized water, Am J Vet Res 51:1116–1120, 1990.
- Grier RL, DiGuardo G, Myers R, et al.: Mast cell tumour destruction in dogs by hypotonic solution, J Sm An Pract 36:385–388, 1995.
- Jaffe MH, Hosgood G, Kerwin SC, et al.: The use of deionized water for the treatment of canine cutaneous mast cell tumors, Vet Cancer Soc Newsl 22:9–10, 1998.
- Jaffe MH, Hosgood G, Kerwin SC, et al.: Deionised water as an adjunct to surgery for the treatment of canine cutaneous mast cell tumours, J Small Anim Pract 41:7–11, 2000.
- Brocks BA, Neyens IJ, Teske E, et al.: Hypotonic water as adjuvant therapy for incompletely resected canine mast cell tumors: a randomized, double-blind, placebo-controlled study, Vet Surg 37:472–478, 2008.
- Asboe-Hanson G: The mast cell: cortisone action on connective tissue, Proc Soc Exp Biol Med 80:677–679, 1952.
- Bloom F: Effect of cortisone on mast cell tumors (mastocytoma) of the dog, Proc Soc Exp Biol Med 80:651–654, 1952.
- Brodey RS, McGrath JT, Martin JE: Preliminary observations on the use of cortisone in canine mast cell sarcoma, J Am Vet Med Assoc 123:391–393, 1953.
- Stanclift RM, Gilson SD: Evaluation of neoadjuvant prednisone administration and surgical excision in treatment of cutaneous mast cell tumors in dogs, J Am Vet Med Assoc 232:53–62, 2008.
- McCaw DL, Miller MA, Ogilvie GK, et al.: Response of canine mast cell tumors to treatment with oral prednisone, J Vet Intern Med 8:406–408, 1994.
- Takahashi T, Kadosawa T, Nagase M, et al.: Inhibitory effects of glucocorticoids on proliferation of canine mast cell tumor, J Vet Med Sci 59:995–1001, 1997.
- Dobson J, Cohen S, Gould S: Treatment of canine mast celltumours with prednisolone and radiotherapy, Vet Comp Oncol 2:132–141, 2004.
- Matsuda A, Tanaka A, Amagai Y, et al.: Glucocorticoid sensitivity depends on expression levels of glucocorticoid receptors in canine neoplastic mast cells, Vet Immunol Immunopathol 144:321–328, 2011.
- McCaw DL, Miller MA, Bergman PJ, et al.: Vincristine therapy for mast cell tumors in dogs, J Vet Intern Med 11:375–378, 1997.
- Rassnick KM, Moore AS, Williams LE, et al.: Treatment of canine mast cell tumors with CCNU (lomustine), J Vet Intern Med 13:601–605, 1999.
- Rassnick KM, Al-Sarraf R, Bailey DB, et al.: Phase II open-label study of single-agent hydroxyurea for treatment of mast cell tumours in dogs, Vet Comp Oncol 8:103–111, 2010.
- Cooper M, Tsai X, Bennett P: Combination CCNU and vinblastine chemotherapy for canine mast cell tumours: 57 cases, Vet Comp Oncol 7:196–206, 2009.
- Grant IA, Rodriguez CO, Kent MS, et al.: A phase II clinical trial of vinorelbine in dogs with cutaneous mast cell tumors, J Vet Intern Med 22:388–393, 2008.
- Taylor F, Gear R, Hoather T, et al.: Chlorambucil and prednisolone chemotherapy for dogs with inoperable mast cell tumours: 21 cases, J Small Anim Pract 50:284–289, 2009.
- Rassnick KM, Bailey DB, Russell DS, et al.: A phase II study to evaluate the toxicity and efficacy of alternating CCNU and highdose vinblastine and prednisone (CVP) for treatment of dogs with high-grade, metastatic or nonresectable mast cell tumours, Vet Comp Oncol 8:138–152, 2010.
- Malone EK, Rassnick KM, Wakshlag JJ, et al.: Calcitriol (1,25 dihydroxycholecalciferol) enhances mast cell tumour chemotherapy and receptor tyrosine kinase inhibitor activity in vitro and has singleagent activity against spontaneously occurring canine mast cell tumours, Vet Comp Oncol 8:209–220, 2010.
- Hayes A, Adams V, Smith K, et al.: Vinblastine and prednisolone chemotherapy for surgically excised grade III canine cutaneous mast cell tumours, Vet Comp Oncol 5:168–176, 2007.
- Rassnick KM, Bailey DB, Flory AB, et al.: Efficacy of vinblastine for treatment of canine mast cell tumors, J Vet Intern Med 22:1390– 1396, 2008.
- Vickery KR, Wilson H, Vail DM, et al.: Dose-escalating vinblastine for the treatment of canine mast cell tumour, Vet Comp Oncol 6:111–119, 2008.
- Singh J, Rana JS, Sood N, et al.: Clinico-pathological studies on the effect of different anti-neoplastic chemotherapy regimens on transmissible venereal tumours in dogs, Vet Res Commun 20:71–81, 1996.
- Serra Varela JC, Pecceu E, Handel I, et al.: Tolerability of a rapidescalation vinblastine-prednisolone protocol in dogs with mast cell tumours, Vet Med Sci 2:266–280, 2016.
- Ma Y, Longley BJ, Wang X, et al.: Clustering of activating mutations in c-KIT’s juxtamembrane coding region of canine mast cell neoplasms, J Invest Dermatol 112:165–170, 1999.
- Liao AT, Chien MB, Shenoy N, et al.: Inhibition of constitutively active forms of mutant kit by multitargeted indolinone tyrosine kinase inhibitors, Blood 100:585–593, 2002.
- Pryer NK, Lee LB, Zadovaskaya R, et al.: Proof of target for SU11654: inhibition of KIT phosphorylation in canine mast cell tumors, Clin Cancer Res 9:5729–5734, 2003.
- London CA, Malpas PB, Wood-Follis SL, et al.: Multi-center, placebo- controlled, double-blind, randomized study of oral toceranib phosphate (SU11654), a receptor tyrosine kinase inhibitor, for the treatment of dogs with recurrent (either local or distant) mast cell tumor following surgical excision, Clin Cancer Res 15:3856–3865, 2009.
- Weishaar KM, Ehrhart EJ, Avery AC, et al.: c-Kit mutation and localization status as response predictors in mast cell tumors in dogs treated with prednisone and toceranib or vinblastine, J Vet Intern Med 32:394–405, 2018.
- Tjostheim SS, Stepien RL, Markovic LE, et al.: Effects of toceranib phosphate on systolic blood pressure and proteinuria in dogs, J Vet Intern Med 30:951–957, 2016.
- London C, Mathie T, Stingle N, et al.: Preliminary evidence for biologic activity of toceranib phosphate (Palladia((R))) in solid tumours, Vet Comp Oncol 10:194–205, 2012.
- Hahn KA, Ogilvie G, Rusk T, et al.: Masitinib is safe and effective for the treatment of canine mast cell tumors, J Vet Intern Med 22:1301–1309, 2008.
- Hahn KA, Legendre AM, Shaw NG, et al.: Evaluation of 12- and 24-month survival rates after treatment with masitinib in dogs with nonresectable mast cell tumors, Am J Vet Res 71:1354–1361, 2010.
- Isotani M, Ishida N, Tominaga M, et al.: Effect of tyrosine kinase inhibition by imatinib mesylate on mast cell tumors in dogs, J Vet Intern Med 22:985–988, 2008.
- Marconato L, Bettini G, Giacoboni C, et al.: Clinicopathological features and outcome for dogs with mast cell tumors and bone marrow involvement, J Vet Intern Med 22:1001–1007, 2008.
- Yamada O, Kobayashi M, Sugisaki O, et al.: Imatinib elicited a favorable response in a dog with a mast cell tumor carrying a c-kit c.1523A>T mutation via suppression of constitutive KIT activation, Vet Immunol Immunopathol 142:101–106, 2011.
- Bavcar S, de Vos J, Kessler M, et al.: Combination toceranib and lomustine shows frequent high grade toxicities when used for treatment of non-resectable or recurrent mast cell tumours in dogs: a European multicentre study, Vet J 224:1–6, 2017.
- Burton JH, Venable RO, Vail DM, et al.: Pulse-administered toceranib phosphate plus lomustine for treatment of unresectable mast cell tumors in dogs, J Vet Intern Med 29:1098–1104, 2015.
- Pan X, Tsimbas K, Kurzman ID, et al.: Safety evaluation of combination CCNU and continuous toceranib phosphate (Palladia((R))) in tumour-bearing dogs: a phase I dose-finding study, Vet Comp Oncol 14:202–209, 2016.
- Robat C, London C, Bunting L, et al.: Safety evaluation of combination vinblastine and toceranib phosphate (Palladia(R)) in dogs: a phase I dose-finding study, Vet Comp Oncol 10:174–183, 2012.
- Carlsten KS, London CA, Haney S, et al.: Multicenter prospective trial of hypofractionated radiation treatment, toceranib, and prednisone for measurable canine mast cell tumors, J Vet Intern Med 26:135–141, 2012.
- Keller A, Wingelhofer B, Peter B, et al.: The JAK2/STAT5 signaling pathway as a potential therapeutic target in canine mastocytoma, Vet Comp Oncol 16:55–68, 2018.
- Kisseberth WC, Murahari S, London CA, et al.: Evaluation of the effects of histone deacetylase inhibitors on cells from canine cancer cell lines, Am J Vet Res 69:938–945, 2008.
- Lin TY, Fenger J, Murahari S, et al.: AR-42, a novel HDAC inhibitor, exhibits biologic activity against malignant mast cell lines via down-regulation of constitutively activated Kit, Blood 115:4217– 4225, 2010.
- Nagamine MK, Sanches DS, Pinello KC, et al.: In vitro inhibitory effect of trichostatin A on canine grade 3 mast cell tumor, Vet Res Commun 35:391–399, 2011.
- Lin TY, Bear M, Du Z, et al.: The novel HSP90 inhibitor STA- 9090 exhibits activity against Kit-dependent and -independent malignant mast cell tumors, Exp Hematol 36:1266–1277, 2008.
- London CA, Bear MD, McCleese J, et al.: Phase I evaluation of STA-1474, a prodrug of the novel HSP90 inhibitor ganetespib, in dogs with spontaneous cancer, PLoS One 6:e27018, 2011.
- Pinello KC, Nagamine M, Silva TC, et al.: In vitro chemosensitivity of canine mast cell tumors grades II and III to all-trans-retinoic acid (ATRA), Vet Res Commun 33:581–588, 2009.
- Ohashi E, Miyajima N, Nakagawa T, et al.: Retinoids induce growth inhibition and apoptosis in mast cell tumor cell lines, J Vet Med Sci 68:797–802, 2006.
- Miyajima N, Watanabe M, Ohashi E, et al.: Relationship between retinoic acid receptor alpha gene expression and growth-inhibitory effect of all-trans retinoic acid on canine tumor cells, J Vet Intern Med 20:348–354, 2006.
- Elders RC, Baines SJ, Catchpole B: Susceptibility of the C2 canine mastocytoma cell line to the effects of tumor necrosis factor-related apoptosis-inducing ligand (TRAIL), Vet Immunol Immunopathol 130:11–16, 2009.
- Peter B, Gleixner KV, Cerny-Reiterer S, et al.: Polo-like kinase-1 as a novel target in neoplastic mast cells: demonstration of growthinhibitory effects of small interfering RNA and the Polo-like kinase-1 targeting drug BI 2536, Haematologica 96:672–680, 2011.
- London CA, Gardner HL, Rippy S, et al.: KTN0158, a humanized anti-KIT monoclonal antibody, demonstrates biologic activity against both normal and malignant canine mast cells, Clin Cancer Res 23:2565–2574, 2017.
- Macy DW: Canine and feline mast cell tumors: biologic behavior, diagnosis, and therapy, Sem Vet Med Surg (Sm An) 1:72–83, 1986.
- Kenyon AJ, Ramos L, Michaels EB: Histamine-induced suppressor macrophage inhibits fibroblast growth and wound healing, Am J Vet Res 44:2164–2166, 1983.
- Huttunen M, Hyttinen M, Nilsson G, et al.: Inhibition of keratinocyte growth in cell culture and whole skin culture by mast cell mediators, Exp Dermatol 10:184–192, 2001.