Врожденный портосистемный шунт — аномальный сосуд, который в обход печени связывает между собой портальную систему вен с системным венозным кровотоком (1, 2).
Портосистемные шунты у собак бывают внепеченочные и внутрипеченочные. Внепечночные шунты чаще всего диагностируют у мелких пород собак, таких как мальтезе, йоркширский терьер или пудель. Внутрипеченочные шунты встречаются в основном у крупных пород собак, например ирландских волкодавов или лабрадоров ретриверов (3-8).
Врожденные портосистемные шунты редко встречаются у кошек (9, 10).
Неврологические симптомы из-за развития печеночной энцефалопатии, являются самыми распространенными у животных с портосистемными шунтами. Несколько реже встречаются симптомы связанные с поражением желудочно-кишечного тракта и мочевыделительной системы (3, 11).
Более подробную информацию о печеночных шунтах (симптомы, диагностика, классификация) у собак, вы можете прочитать в ЭТОЙ статье.
Хирургическое лечение шунта (операция) рекомендовано в большинстве случаев, с целью нормализации кровотока в портальной системе и устранения клинических симптомов (2, 9, 12-14).
Существует большое количество оперативных методов одномоментной или постепенной окклюзии шунта: лигирование шовным материалом, установка амероидного констриктора, целлофанового бандажа или гидравлического окклюдера, внутрисосудистая эмболизация.
Медицинское лечение собак и кошек с портосистемными шунтами показано перед оперативным лечением или при невозможности проведения операции.
Оперативное лечение собак с портосистемными шунтами, позволяет получить большую продолжительность жизни по сравнению с медикаментозным лечением.
Сокращения: ПСШ — портосистемный шунт; ПЭ — печеночная энцефалопатия; ПГ — портальная гипертензия; ЖКТ — желудочно-кишечный тракт; КТ — компьютерная томография; АК — амероидный констриктор; ЦБ — целлофановый бандаж; ГО — гидравлический окклюдер.
Оглавление
Медикаментозное лечение портосистемных шунтов у собак
Медикаментозную терапию врожденных портосистемных шунтов у собак проводят (12, 13, 15):
- Перед оперативным вмешательством для стабилизации состояния;
- После оперативного лечения, так как окклюзия шунта происходит постепенно;
- При невозможности оперативного лечения (морфология шунта, отказ владельца).
Медицинская терапия направлена на снижение продукции и абсорбции желудочно-кишечным трактом токсинов. Медикаментозная терапия может контролировать выраженность клинических симптомов, однако она не влияет на первопричину (не устраняет шунтирующий сосуд).
Как правило, медицинская терапия состоит из коррекции диеты и назначении лактулозы с антибиотиками. Рекомендовано проведение медикаментозной терапии, в течение минимум 2 недель, перед оперативным вмешательством по устранению портосистемного шунта (1, 16).
Хирургическая операция рекомендована собакам с врожденными внепеченочными портосистемными шунтами, так как она улучшает качество и продолжительность жизни по сравнению с медикаментозным лечением (12, 17).
Правильное питание очень важно для собак и кошек с врожденными ПСШ (1, 18). Животные должны получать полнорационную, сбалансированную, вкусную и легкоусвояемую пищу, содержащую необходимое количество белка, витаминов и минералов.
Собаки и кошки без признаков печеночной энцефалопатии (ПЭ) не нуждаются в сильном ограничении потребления белка, особенно если у них низкий индекс массы тела (19, 20). Сильное ограничение потребления белка может привести к распаду мышечных тканей, что будет увеличивать количество аммиака в крови и провоцировать ПЭ (19, 21). Оптимальная диета должна содержать 18-21% белка для собак и 30-35% для кошек в пересчете на сухую массу продукта (1).
Для собак с признаками печеночной энцефалопатии можно рекомендовать, не содержащую мясо, белковую диету на основе молочной продукции или овощей (19, 20). Однако в клинической практике, обычно назначают коммерческие (лечебные) диеты для собак с заболеванием печени (18, 20, 22-24), так как они позволяют точно контролировать количество потребляемых питательных веществ животным.
Стоит избегать приема лечебных диет для собак с заболеванием почек, так как они значимо ограничены по количеству белка (24). Хотя в случаях выраженной печеночной энцефалопатии, такая диета может быть оправдана для краткосрочного приема.
Частый и дробный прием пищи помогает минимизировать риски развития печеночной энцефалопатии (18). Необходимо отслеживать вес тела и кондицию животного, количество мышечной массы и уровень альбумина в крови (18, 20).
После проведения оперативного лечения портосистемного шунта, постепенно, в течение 2-3 месяцев, собак переводят на обычный рацион питания (8, 24).
Лактулоза является неабсорбируемым в кишечнике синтетическим дисахаридом, который можно применять орально или ректально. Лактулозу используют для абсорбции аммиака и других токсинов (1, 18, 22) у животных с портосистемными шунтами и печеночной энцефалопатией.
Лактулоза метаболизируется бактериями толстой кишки до органических кислот (молочной, уксусной и муравьиной), которые повышают осмотическое давление, притягивая воду в кишечник, и подкисляют содержимое толстой кишки (25). Закисление содержимого толстой кишки приводит к преобразованию аммиака в неабсорбируемый аммоний и изменяет микрофлору толстой кишки, подавляя рост бактерий, продуцирующих аммиак (25). Ускорение времени прохождения пищи по кишечнику, связанное с осмотической диареей, уменьшает доступное время для производства и всасывания аммиака (18, 26).
Начинают с минимальной дозы лактулозы, которую постепенно увеличивают до появления более размягченного стула несколько раз в сутки (таблица 1)(18, 22). Возможные побочные эффекты приема лактулозы: рвота, диарея, анорексия, потеря калия и воды, метеоризм в ЖКТ (27).
| Антибиотики | |
| Метронидазол | 7.5 мг/кг/12 часов |
| Амоксициллин | 22 мг/кг/12 часов |
| Ампициллин | 22 мг/кг/6часов |
| Неомицин (избегать в случаях желудочно-кишечного кровотечения или изъязвления, почечной недостаточности, является ототоксичным и нефротоксичным) | 20 мг/кг/12 часов |
| Слабительные | |
| Лактулоза | Орально: от 2.5 до 25 мл 3 раза в сутки (2-3 дефекации в сутки) Собакам: начинают обычно с 0.5 мл/кг/8 часов Кошкам: начинают с 2.5-5 мл 3 раза в сутки |
| Гастропротекторы | |
| Ингибиторы протонной помпы | |
| Омепразол | 0.9-1 мг/кг/12 часов |
| Эзомепразол | 1 мг/кг/12 часов |
| Сукральфат | 1 г на 25 кг 3 раза в сутки |
Если изменение диеты и прием лактулозы не улучшает течение заболевания, то необходимо применение антибиотиков для изменения микрофлоры толстой кишки, с целью уменьшения количества бактерий, продуцирующих уреазу, что приведет к снижению продукции и всасывания аммиака (28).
У животных с печеночной энцефалопатией используют метронидазол, неомицин и ампициллин (таблица 1)(15, 18, 22).
Неомицин на данный момент не рекомендован в клинической практике из-за его ототоксического и нефротоксического действия.
Метронидазол стоит использовать в сниженной дозировке у собак и кошек с печеночной энцефалопатией из-за ПСШ, так как он активно метаболизируется в печени.
В одном исследовании оценивался эффект приема метронидазола, лактулозы и лечебной диеты для стабилизации состояния перед оперативным лечением собак с ПСШ (29). По результатам исследования, дополнительное применение метронидазола не давало значимых преимуществ в стабилизации состояния.
Рифаксимин является полусинтетическим неабсорбируемым производным рифампицина, который эффективен у людей с печеночной энцефалопатией (30). Рифаксимин эффективнее неомицина, снижает уровень аммиака в крови и улучшает клиническое проявление печеночной энцефалопатии (31). К сожалению, в ветеринарии, на данный момент, нет исследований оценивающих его эффективность у собак с ПЭ.
Собаки с внутрипеченочными шунтами (до и после операции) склонны к развитию язв в желудочно-кишечном тракте (5). При подозрении или наличии эрозий и язв в ЖКТ, рекомендуют использовать гастропротекторы, особенно эффективны ингибиторы протонной помпы (таблица 1) и сукральфат (1, 22).
Собаки и кошки с портосистемными шунтами могут поступать в острый период печеночной энцефалопатии, с такими симптомами, как судороги, летаргия или кома (3, 32-34). У таких животных могут быть провоцирующие ПЭ факторы: обезвоживание, высокобелковое питание, кровотечение в ЖКТ, уремия, запоры или сепсис (18, 22). Принимаемые медикаменты, вызывающие обезвоживание, нарушение электролитного баланса и гепатотоксичность, стоит по возможности отменить до стабилизации состояния.
В терапию острого криза печеночной энцефалопатии можно добавить клизмы с 30% водным раствором лактулозы (10-15 мл/кг) и прием антибиотиков, для снижения уреаза-продуцирующих бактерий (метронидазол, ампициллин или амоксициллин)(18, 22).
Судороги (до и после операции) у животных с ПЭ на фоне ПСШ купируются антиконвульсантами. Применение бензодиазепинов, таких как диазепам или мидазолам, для контроля судорог из-за ПЭ неоднозначно. У людей, применение бензодиазепинов, является провоцирующим развитие печеночной энцефалопатии фактором (35).
У животных для купирования ПЭ используют: леветирацетам (препарат выбора), фенобарбитал, пропофол и калия бромид.
В нескольких медицинских исследованиях, были сделаны выводы, что возможная активация гамма-аминомасляной кислоты (ГАМК)/бензодиазепиновой ингибирующей нейротрансмиттерной системы способствует патогенезу ПЭ (36-38).
Флумазенил, антагонист центрально действующих рецепторов гамма-аминомасляной кислоты (ГАМК), реализует свой механизм действия путем конкурентного ингибирования бензодиазепинового участка на рецепторе ГАМК (39). В метаанализе, проведенном доктором Goulenok и коллегами (2002), было показано, что флумазенил вызывает клиническое и электроэнцефалографическое улучшение течения печеночной энцефалопатии у пациентов с циррозом печени (40). Однако надежность этого исследования оценивается, как низкая.
В настоящее время, данные о положительной эффективности флумазенила при лечении людей с печеночной энцефалопатией ограничены. Вероятно, он приносит небольшую пользу при острых эпизодах ПЭ, особенно в ситуациях интоксикации или передозировки бензодиазепинов.
Эффективность флумазенила была оценена в одном исследовании на собаках, однако улучшений от приема данного препарата не наблюдалось (41).
Хирургическое лечение врожденных портосистемных шунтов у собак
Оперативное лечение портосистемных шунтов заключается в лигировании (постепенной или острой) аномального сосуда для восстановления нормального тока крови по портальной вене в ткани печени. Нормализация кровотока приводит к развитию портальных сосудов и восстановлению тканей печени (42-46).
Шунтирующий сосуд может быть лигирован одномоментно при помощи нерассасывающегося шовного материала или постепенно при помощи амероидного констриктора, целлофанового бандажа или окклюдера (3, 47-52).
Большинство портосистемных шунтов у собак и кошек нельзя лигировать одномоментно из-за развития жизнеугрожающей портальной гипертензии (53-55). С этой целью широкое распространения получили методы постепенной окклюзии шунтов.
Хирургическое лечение внутрипеченочных шунтов более комплексное по сравнению с внепеченочными из-за локализации аномального сосуда внутри печени (56, 57).
КТ-ангиография является надежным, быстрым и безопасным методом диагностики портосистемных шунтов, она также позволяет оценить морфологию шунта и спланировать оперативное вмешательство (58, 59).
Биопсию печени проводит для сравнительной оценки и получения информации о ее состояния на момент операции (выраженность фиброза, сосудистых изменения и т.д.)(60)
Устранение портосистемного шунта у собак при помощи лигатуры
Лигирование шунта при помощи шелковой или полипропиленовой нити — первый описанные метод хирургического лечения ПСШ (рисунок 1). При помощи лигатур, можно провести полную или частичную окклюзию шунта.
Примерно 50-80% собак и 82-85% кошек не переносят одномоментное полное лигирование шунта из-за недоразвитости портального кровотока, что приводит к портальной гипертензии (ПГ)(42, 49, 52-55, 57, 61-65).
Интраоперационно проводят измерение давления в портальной системе для оценки возможности полной окклюзии шунта. Если после операции давление в портальной системе достигает 17-24 см водного столба или давление после лигирования возросло более чем на 9-10 см водного столба, то у животного крайне высокие риски развития портальной гипертензии (4, 53, 66-68)(рисунок 2).
Стоит также мониторить системное венозное давление в ходе лигирования шунта. Снижение давления более чем на 1 см водного столба, связано с развитием ПГ (53).
Стоит учитывать, при измерении давления, влияние глубины анестезии, статуса гидратации, фазы дыхания, состояния внутренних органов и других системных факторов (53, 68-71).
Признаками развития ПГ во время операции, после лигирования шунта, могут быть: синюшный цвет кишечника, его частая перистальтика, усиленная пульсация сосудов ЖКТ, отек поджелудочной железы (72).
Если одномоментная полная окклюзия шунта невозможна, проводят его частичное лигирование, а через некоторое время во время повторной операции, окончательно устраняют кровоток в аномальном сосуде. Такие рекомендации связаны с лучшим прогнозом, при полном отсутствии кровотока через портосистемный шунт (17, 43, 53-55, 57, 65, 73).
В одном исследовании собак с внутрипеченочными портосистемными шунтами, только у 18.5% животных было возможно провести одномоментное лигирование шунта (65). Тем не менее, при невозможности полного лигирования, проводят частичную окклюзию шунта, а далее полностью его устраняют во время повторной операции. Так в одном исследовании, такой подход оказался эффективным у 27/33 (81.8%) собак (65).
В еще одном исследовании, полное лигирование сосуда было возможно в 76% собак с внепеченочными портосистемными шунтами (74).
Интересной находкой является нормализация уровня желчных кислот и аммиака, у некоторых собак с частичным лигированием портосистемных шунтов, что может быть связано с дальнейшим сужением просвета сосуда уже после наложения лигатур (55, 73, 75).
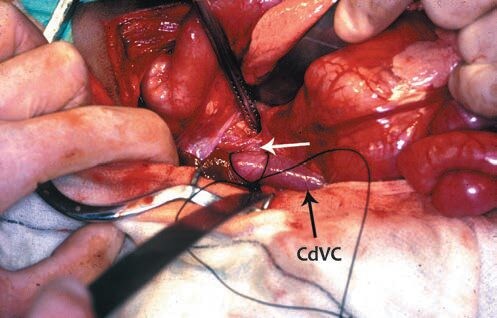
Рисунок 1. Лигирование внепеченочного портосистемного шунта у собаки при помощи шелковой лигатуры.
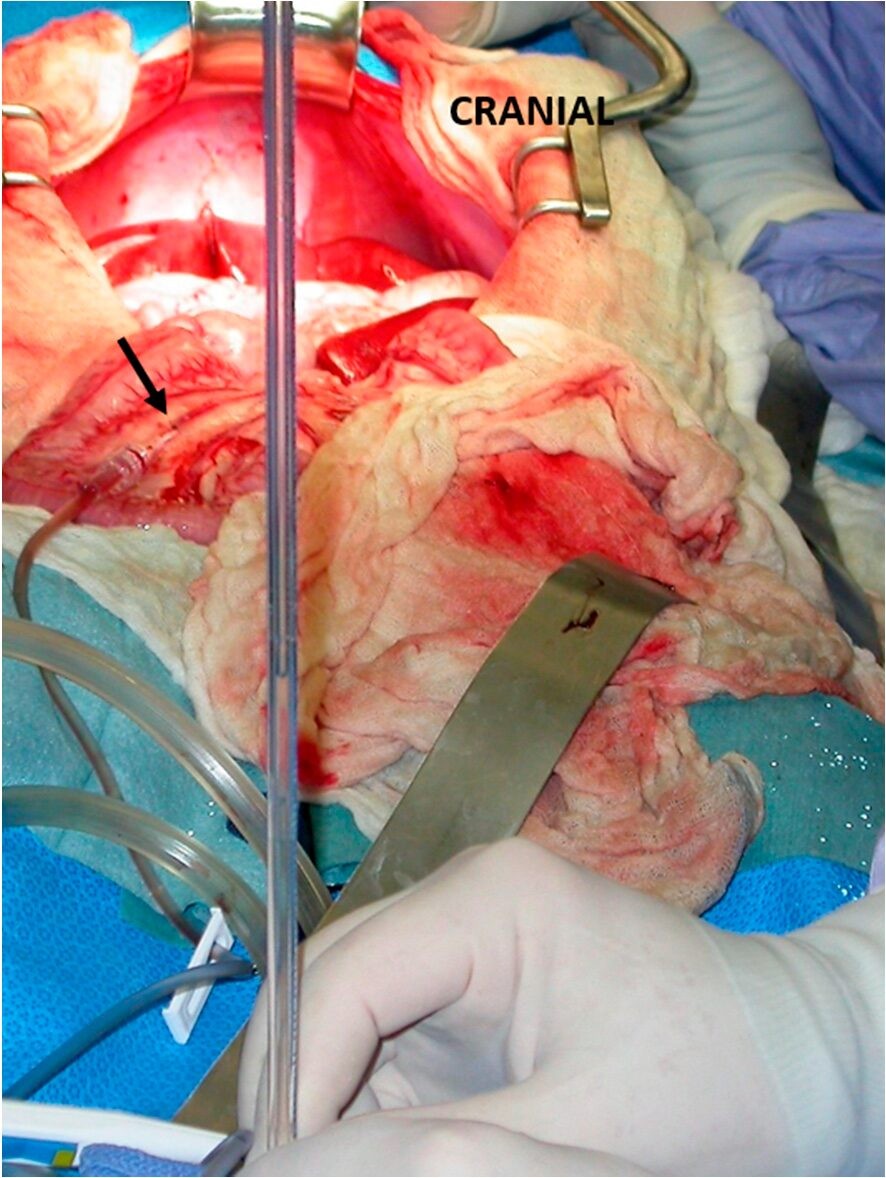
Рисунок 2. Измерение давление в портальной системе у собаки.
Методы постепенной окклюзии портосистемного шунта у собак
Постепенная окклюзия портосистемного шунта позволяет печени адаптироваться к возобновлению нормального кровотока через портальную вену и избежать развития портальной гипертензии.
Чаще всего для постепенной окклюзии ПСШ у собак и кошек используют амероидные констрикторы (рисунок 3 и 4) или целлофановые бандажи (рисунок 5).
Амероидный констриктор (АК) можно использовать при внепеченочных и внутрипеченочных шунтах. Констриктор состоит из внутреннего кольца со спрессованным казеином и внешнего кольца из хирургической стали с замком (76). Под воздействием влаги, казеин разбухает, что приводит к постепенной окклюзии шунта, за счет его компрессии, фиброза и тромбоза, в течение 2-5 недель после установки (1, 45, 50, 76). Наибольшие темпы разбухания казеина, наблюдаются в первые 3-14 дней после имплантации, далее они постепенно снижаются, пока внутренней диаметр кольца не уменьшится до 32% (47).
Применение амероидного констриктора позволяет постепенно перекрыть кровоток через портосистемный шунт, что дает время адаптироваться портальной системе вен к усиленному кровотоку, тем самым снижая риски развития портальной гипертензии (76).
Несмотря на постепенное закрытие портосистемного шунта после установки амероидного констриктора, у собак могут развиться вторичные шунты (до 40% при внутрипеченочных шунтах и до 17% при внепеченочных)(3, 63, 76).
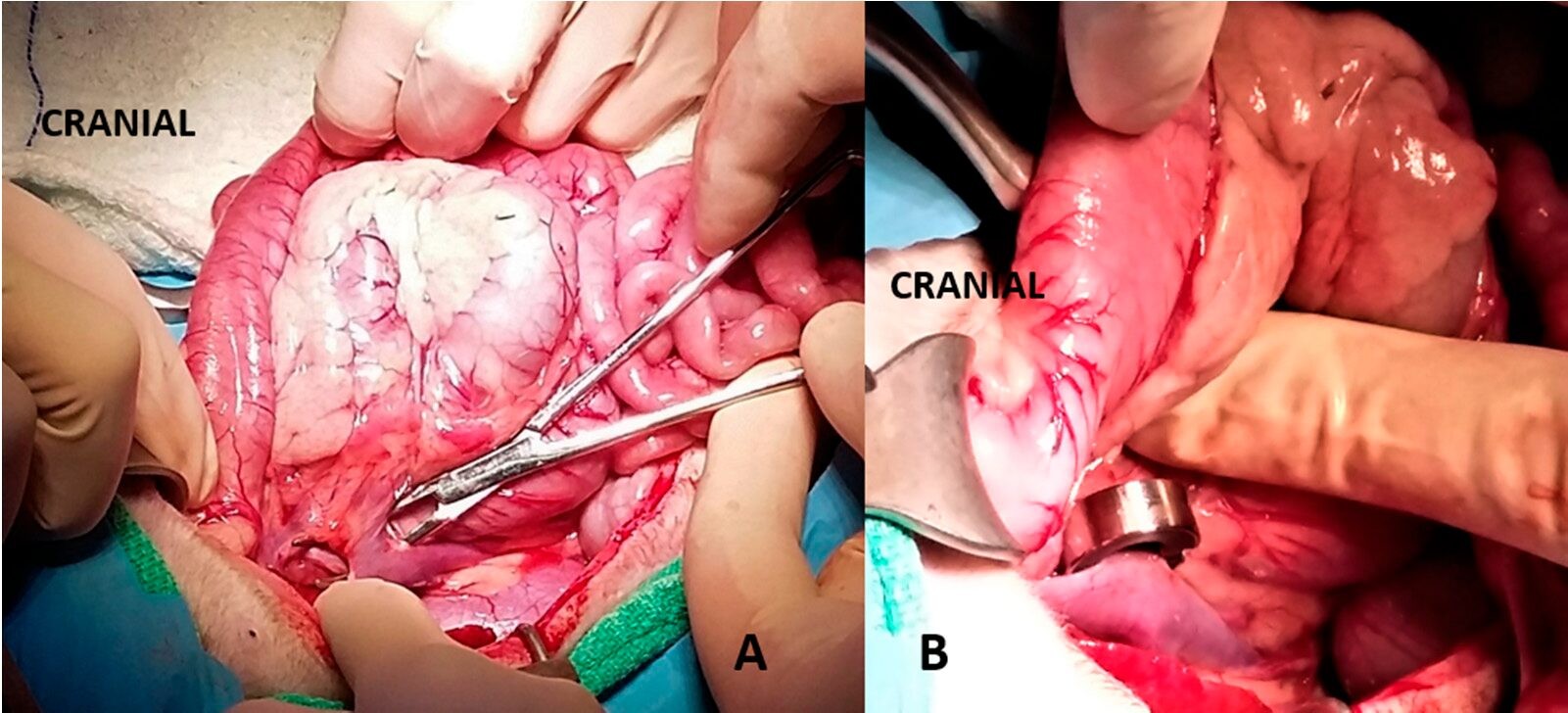
Рисунок 3. (А) Над браншами инструмента располагается портокавальный шунт у собаки; (B) На шунт установили амероидный констриктор.
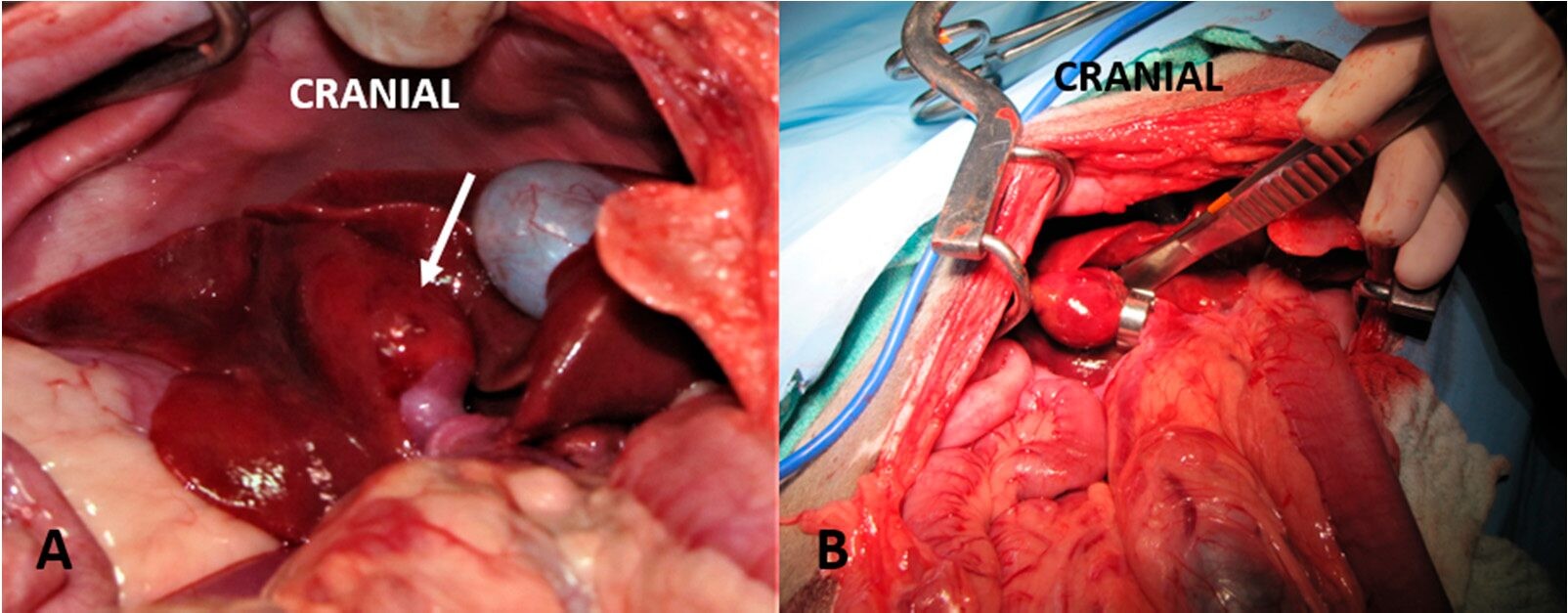
Рисунок 4. (А) Внутрипеченочный портосистемный шунт у собаки, расположенный в хвостатой доле печени и формирующий аневризму (стрелка); (B) Амероидный констриктор установили вокруг правой портальной вены, которая кровоснабжает хвостатую долю.
Применение целлофанового бандажа (ЦБ), является альтернативой амероидным констрикторам. Целлофановый бандаж вызывает фиброзирование окружающих тканей с постепенной окклюзией шунта (50).
Как правило, используют целлофан немедицинского назначения, который разрезают на полоски (1-1.2 см x 10 см) и стерилизуют (1, 79). Полоску целлофана проводят вокруг портосистемного шунта и фиксируют гемостатической клипсой.
Применение целлофанового бандажа для окклюзии портосистемного шунта, впервые предложено доктором Breznock в 1979 году и проведено доктором Harari с коллегами в 1990 году (66, 80). В этом исследовании использовали полоски целлофана 3 мм в ширину, которые установили вокруг портоазигонального шунта (с его окклюзией примерно на 50%).
С тех пор, целлофановые бандажи активно используют у собак и кошек с портосистемными шунтами (51, 81-85). Изначально, при использовании ЦБ, диаметр шунта уменьшали до 3 мм (51). Однако, в дальнейших исследованиях, были получены результаты о полной окклюзии шунта без необходимости сужения диаметра сосуда до 3 мм у собак с внепеченочными портосистемными шунтами (48).
Неполное закрытие шунта описано у кошек после применения ЦБ, что вероятно связано с менее выраженной воспалительной реакцией и фиброзированием у данного вида животных (51, 86, 87).
В исследовании, проведенном на 34 кошках с внепеченочными портосистемными шунтами, у которых использовался целлофановый бандаж, нормализация уровня желчных кислот наблюдалась в 25 из 28 случаев после операции, и только у одной кошки сохранился функционирующий сосуд во время проведения повторной операции (88).
Использование аналога ЦБ из тонкой пленки на основе полиолефиновых волокон у собак с внепеченочными шунтами, привел к схожим с применением АК результатам (89).
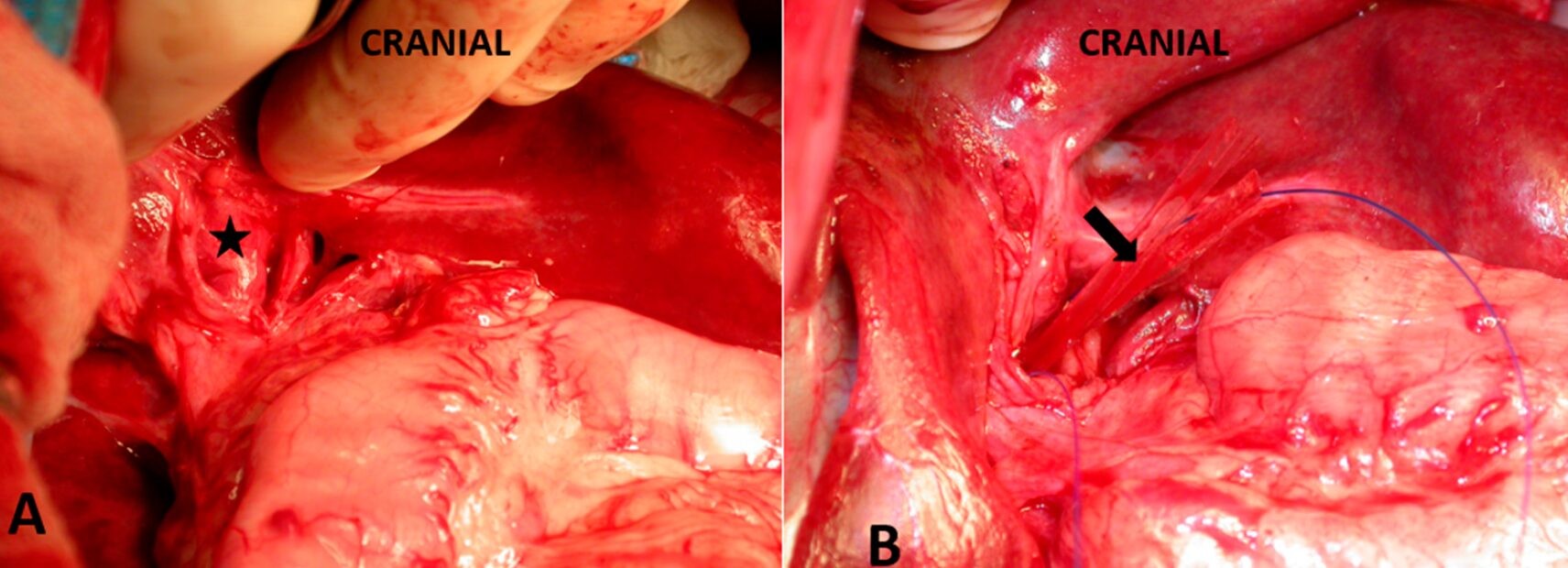
Рисунок 5. (А) Правосторонний портосистемный шунт отмечен звездочкой; (B) Вокруг шунта провели полоску из целлофана (отмечена стрелкой).
Гидравлический окклюдер (ГО)(рисунок 6) представляет из себя надувную манжету из силикона и полиэстера, соединенную при помощи трубки с портом, который располагается под кожей.
Манжету устанавливают вокруг портосистемного шунта, как и амероидный констриктор, и фиксируют ее при помощи нерассасывающейся нити. После операции, надувают манжету физиологическим раствором при помощи порта, расположенного под кожей.
ГО позволяет постепенно полностью перекрыть кровоток через шунтирующий сосуд, а скорость окклюзии можно подбирать для каждого пациента индивидуально, ориентируясь на клинические симптомы и анализы крови.
Публикаций об использовании ГО у животных с шунтами мало (47). В одном исследовании на 10 собаках с внутрипеченочными шунтами, использовали ГО, размещенный вокруг портальной вены кровоснабжающей шунт. Небольшое количество стерильного физиологического раствора вводили в порт гидравлического окклюдера каждые 2 недели, закрытие шунта происходило в течение 6-8 недель. У 3 из 10 собак лопнула манжета окклюдера и у 2 из 10 собак развился асцит, что потребовало остановить на время раздувание манжеты.
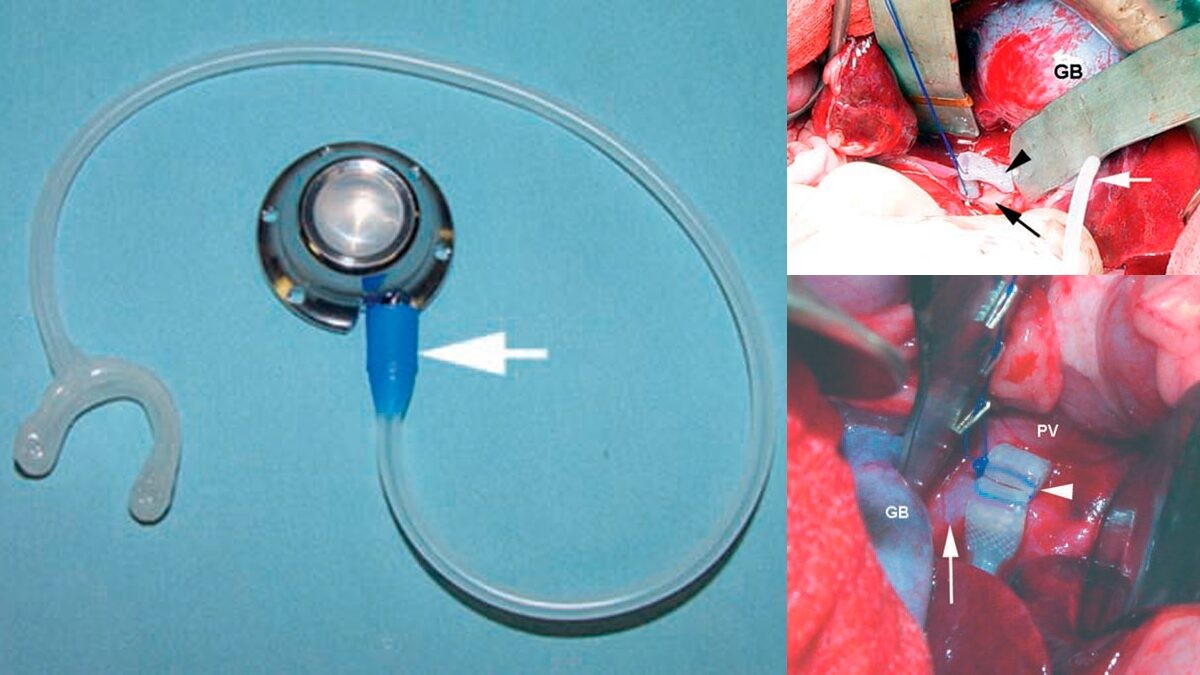
Рисунок 6. Применение гидравлического окклюдера у собаки с портосистемным шунтом.
Использование самосжимающегося устройства из полиакриловой кислоты и силикона (рисунок 7) — еще один очень перспективный метод постепенной окклюзии внепеченочных портосистемных шунтов у собак и кошек (90).
Устройство вызывает окклюзию шунта при помощи постепенного физического сжатия, в течение 6-8 недель после имплантации. При данном методе окклюзия шунта не зависит от процессов воспаления, фиброза или тромбоза. Плюсами устройства является прогнозируемое время закрытия и простота установки.
В клиническом исследовании устройства, полная окклюзия портосистемного шунта в течение 8 недель, произошла у 4 из 6 собак, а у 2-ух оставшихся животных сохранился клинически не значимый кровоток в сосуде (90).
К сожалению, коммерческая версия устройства недоступна для продажи на данный момент.
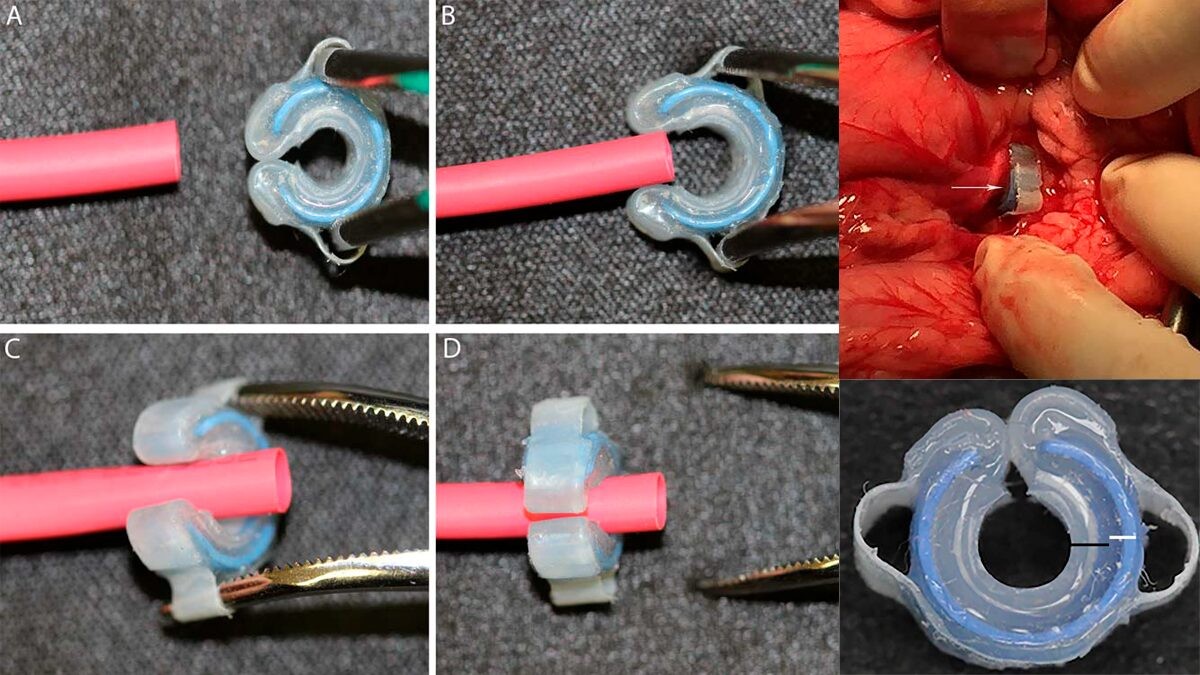
Рисунок 7. Применение самосжимающегося устройства из полиакриловой кислоты и силикона для лигирования портосистемного шунта у собаки.
Чрескожная трансвенозная окклюзия шунтов эмболизирующими спиралями
Популяризация интервенционной радиологии в ветеринарии мелких животных, привела к использованию эмболизирующих спиралей у собак и кошек с внутрипеченочными и внепеченочными шунтами (33, 82, 91-95).
Данная техника является неинвазивной, быстрой и многообещающей для окклюзии внутрипеченочных портосистемных шунтов. Эмболизирующая спираль — это гибкая металлическая проволока с множеством полиэфирных волокон, которую размещают внутри сосуда под контролем рентгеноскопии.
Эмболизирующая спираль снижает кровоток в сосуде двумя путями: (1) первично, из-за своего физического присутствия и (2) вторично, из-за развития тромбоза. Окклюзия происходит в течение 1-2 месяцев. При установке спиралей проводят измерение давления в портальной системе (5).
При необходимости, в будущем, возможно дополнительное введение спиралей, если не произошла полная окклюзия шунта.
Основным осложнением применения спиралей является портальная гипертензия из-за слишком быстрого образования тромбов или миграции спиралей. Применение спиралей без полиэфирных волокон или послеоперационная противотромбовая терапия могут быть методами профилактики развития фатальной портальной гипертензии (91, 96).
Миграция спиралей в сердце или легкие из-за высокой скорости тока крови или большого диаметра шунта — еще одно возможное осложнение данной техники (91, 97, 98) . Установка стента в каудальную полую или печеночную вену, профилактирует миграцию спиралей (94, 96-98).
В настоящее время не существует «наилучшего» метода из-за отсутствия большого количества данных о долгосрочных результатах лечения внепеченочных или внутрипеченочных шунтов у собак (17, 65, 99, 100).
Осложнения после хирургического лечения портосистемных шунтов у собак
Развитие портальной гипертензии является основным осложнением при одномоментном лигирование портосистемного шунта у собак (48, 51, 53-55, 57, 77, 78, 101).
Симптомы острой и выраженной ПГ: абдоминальная боль, асцит, илеус, гиповолемический шок, рвота и диарея, содержащая в себе свежую или переваренную кровь (1, 2). В случаях развития ПГ легкой или средней степени, может отмечаться только асцит.
Собакам с острой ПГ требуется введение кристаллоидов, анальгезия, гастропротекторы и согревание при гипотермии (4). В случае выраженного асцита, хороший эффект дает применение спиронолактона и/или фуросемида. Стоит избегать гипергидратации, внешнего сдавления брюшной полости и кормления большими порциями (102).
Послеоперационные неврологические нарушения развиваются примерно у 3.6-12% собак и 36.7-60% кошек с портосистемными шунтами (5, 42, 52, 72, 101, 103-108).
Симптомы варьируются от небольшой атаксии, депрессии и дезориентации до генерализованной судорожной активности (63, 72, 104, 106, 109, 110).
Развитие судорог после операции часто являлось фатальным осложнением, по данным ряда исследований (52, 88, 103, 105, 109, 111). Чаще всего судороги развиваются у мелких пород собак с внепеченочными портосистемными шунтами, однако они описаны и у собак с внутрипеченочными шунтами и могут развиться в течение 3 суток после операции (112). Иногда до развития судорог отмечаются симптомы атаксии, депрессии, дезориентации, вокализации, слепоты и тремора мышц (104).
Точный механизм развития судорог неизвестен, потенциальными провоцирующими факторами могут быть: снижение системной концентрации эндогенных бензодиазепинов, дисбаланс нейротрансмиттеров, гипогликемия, печеночная энцефалопатия, гипоксемия, системная гипертензия и дисбаланс электролитов (104, 106, 112-116, 117).
Было сделано предположение, что применение противосудорожных препаратов перед операцией, может снизить частоту развития судорог после операции. Однако, применение калия бромида в течение 2 недель перед операцией не снизило частоту возникновения судорог (3). Применение фенобарбитала тоже значимо не повлияло на частоту развития неврологических нарушений (104). Эффективность предоперационного применения леветирацетама (20 мг/кг/8 часов минимум за сутки) оказалось неоднозначной в разных исследованиях (105, 111, 116).
Применение бензодиазепинов, барбитуратов и пропофола для лечения эпилептического статуса неоднозначно, а эффективность в исследованиях противоречива (72, 104, 106, 117, 118). Всегда важно исключить гипогликемию, печеночную энцефалопатию и нарушение электролитного баланса, как провоцирующих судороги факторов.
Старший возраст животного, наличие печеночной энцефалопатии до операции, морфология шунта (портоазигональный), порода собаки (мопсы) — факторы повышенного риска развития судорог после операции. (51, 81, 104, 111, 115, 117).
Прогноз у собак и (особенно) кошек с портосистемными шунтами, при развитии судорог после операции, плохой (3, 52, 107, 112, 117).
Клинически значимая гипогликемия — другое возможное осложнение после операции. В одном исследовании, у 7 из 16 собак развилась гипогликемия, а у 2 из 7 она не отвечала на внутривенное введение декстрозы (7). Собаки с рефракторной гипогликемией, могут ответить на введение глюкокортикостероидов (дексаметазон 0.1-0.2 мг/кг внутривенно, однократно).
Сохранение или рецидив клинических симптомов — еще одно возможное осложнение после проведения операции по устранению портосистемного шунта (32, 83, 87, 119, 120). Возможные причины: неполная окклюзия шунта, неоптимальное место окклюзии шунта и развитие вторичных шунтов.
Если у собаки сохраняются клинические симптомы или отклонения по анализам в течение 5-6 месяцев после операции, то необходимо визуально оценить состояние шунта при помощи компьютерной томографии или ультразвукового исследования (1).
Сохранение кровотока по внепеченочному портосистемному шунту после операции, может достигать у собак 21% при использовании амероидного констриктора (АК) и 35% при использовании целлофанового бандажа (ЦБ), а у кошек 57% при использовании АК и 3-20% при использовании ЦБ (3, 45, 51, 88, 108, 120). Несмотря на такую статистику, в большинстве случаев, сохранение кровотока незначительное и не приводит к появлению клинических симптомов.
Концентрацию желчных кислот и аммиака часто используют для послеоперационного мониторинга. Однако, эти тесты не могут точно определить закрытие шунта (121). Нормальная концентрация аммиака не исключает сохранение кровотока по шунту (121, 122), так чувствительность определения уровня аммиака после кормления, является низкой (19-44%), но специфичной (100%).
Повышенная концентрация желчных кислот может сохраняться у собак после полного закрытия внепеченочного портосистемного шунта или быть в норме у собак с сохраненным кровотоком через шунт (121, 122).
Послеоперационные методы визуализации до сих пор необходимы для оценки степени закрытия шунта и исключения появления новых шунтов. Однако, большей части животных не проводят контрольные визуальные исследования, если у них отсутствуют клинические признаки портосистемного шунта или печеночной недостаточности.
Качество жизни собак с внепеченочными портосистемными шунтами, которые лечили оперативно, значительно лучше, даже при сохранении небольшого кровотока через шунт (127).
Приобретенные (вторичные) портосистемные шунты развиваются из-за открытия эмбриональных сосудов между портальной веной и каудальной или непарной веной. Эти сосуды становятся функциональными при высокой разнице в давлении между портальным и системным кровотоком.
Приобретенные портосистемные шунты выглядят как множество мелких и извитых сосудов, расположенных обычно между левой почечной веной, прямой кишкой и селезеночной веной. Однако они могут встречаться в любом месте в брюшной полости (рисунок 8)(128, 129).
Приобретенные шунты развиваются в 0-17.5% случаев при использовании АК и 6-18% случаев при использовании ЦБ для устранения внепеченочного портосистемного шунта и связаны с портальной гипертензией (3, 32, 38, 51, 55, 83, 87, 119).
У другим причинам появления вторичных шунтов относят: артериовенозные мальформации печени, первичная гипоплазия портальной вены, хронический гепатит и цирроз печени (130, 131).
Окончательный диагноз ставят на основании данных визуальной диагностики или диагностической лапаротомии. Не рекомендовано лигирование вторичных портосистемных шунтов, так как это спровоцирует развитие портальной гипертензии (127, 130, 132-134).
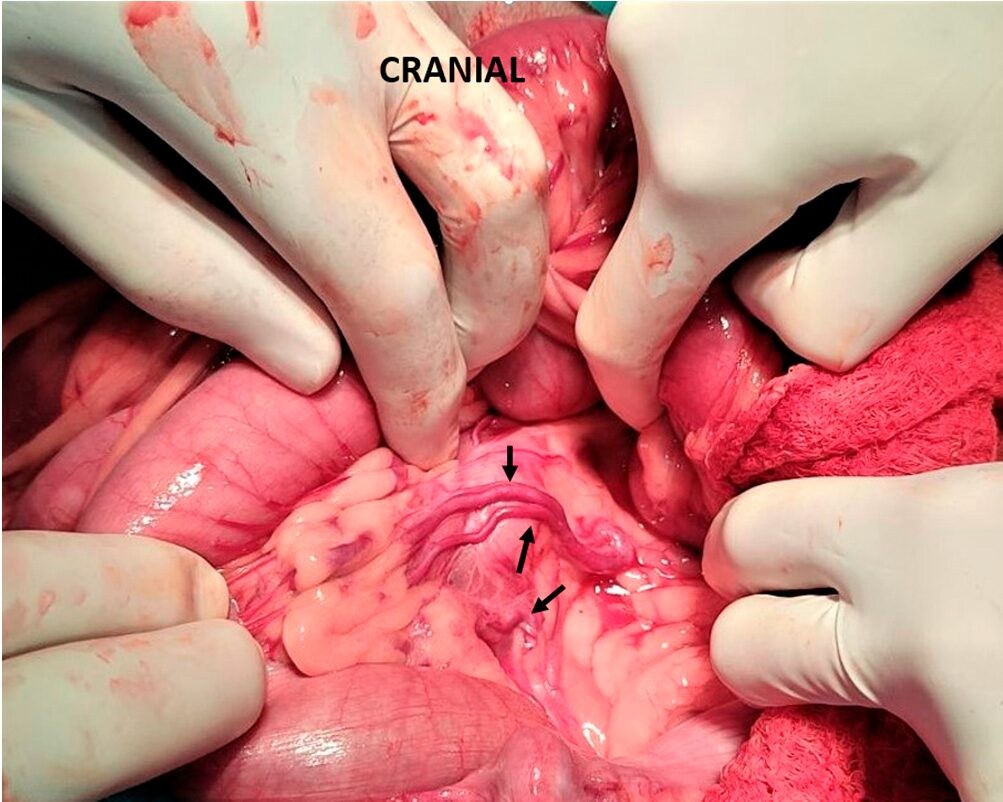
Рисунок 8. Множественные приобретенные (вторичные) шунты у собаки (отмечены стрелкой).
Послеоперационный мониторинг и уход
Медикаментозную терапию продолжают после операции (1, 65). Контрольные исследования функции печени необходимо проводить у собак и кошек через 2-3 месяца после операции (1, 2, 52).
Если результаты анализов в норме и нет клинических симптомов, то медикаментозную терапию постепенно отменяют. При наличие отклонений по анализам, проводят контрольные исследования через 5-6 месяцев после операции (1). Если клинические симптомы сохраняются или есть отклонения по анализам, то необходимо провести визуальные методы (УЗИ или КТ)(121).
Прогноз и результаты
Есть множество исследований, посвященных прогнозу, осложнениям и летальности у собак и кошек с портосистемными шунтами. Возраст собаки на момент проведения операции не коррелирует с послеоперационной смертностью и длительными результатами окклюзии ПСШ (11, 135).
Масса тела, у собак, которым проводили окклюзию внепеченочного ПСШ при помощи АК не влияет на летальность или долгосрочные результаты (3). Однако собаки с массой тела более 10 кг и внутрипечёночными ПСШ, имеют более осторожный краткосрочный прогноз (64).
Анемия является негативным долгосрочным прогностическим фактором у собак с внутрипеченочными и внепеченочными ПСШ (4, 64). Гипопротеинемия, гипоальбуминемия и азотемия, являются негативным краткосрочным прогностическим фактором, а гипопротеинемия и низкий гематокрит — негативным долгосрочным прогностическим фактором у собак с внутрипеченочными ПСШ (64).
Предоперационный лейкоцитоз и нейтрофилия — негативные долгосрочные прогностические факторы у собак с внепеченочными портосистемными шунтами (3, 64). Неоднозначные результаты получены при оценки влияния концентрации желчных кислот на долгосрочный прогноз у собак с внепеченочными ПСШ (32, 54).
У собак, которым провели лигирование портосистемного шунта при помощи нитей, портальное давление до лигирования, при временной тестовой окклюзии и после лигирования, не коррелировало с долгосрочным результатом лечения (54, 55). Логично, что собаки, которые хорошо перенесли одномоментное полное лигирование шунта, имели лучший прогноз по сравнению с животными, которые смогли перенести только частичное лигирование (49, 54, 55, 73).
Негативным прогностическим фактором у собак с внепеченочными портосистемными шунтами и установкой АК, является увеличение в объеме живота после операции (3). Если после операции появились судороги, то краткосрочный и долгосрочный прогноз является плохим (3, 52, 107, 112, 117).
При проведении операции по устранению внепеченочного ПСШ у собак, периоперационная летальность составляет: 2-32% при использовании лигатур, 7% — АК и 6-9% — ЦБ (3, 11, 32, 43, 48, 49, 51, 55). У собак с внутрипеченочными ПСШ: 6-23% при использовании лигатур, 0-9% — АК и 27% — ЦБ (11, 49, 51, 57, 64, 136-138). У кошек с внепеченочными ПСШ периоперационная летальность составляет: 4-20% при использовании лигатур, 0-4,5% — АК и 0-22% — ЦБ (51, 52, 57, 85, 107, 108, 139, 140).
Выводы и заключение
Хирургическое устранение врожденного портосистемного шунта у собак и кошек является наиболее эффективным методом лечения. Существует несколько методов постепенной или одномоментной окклюзии ПСШ. Самыми распространенными методами на данный момент являются — установка амероидного констриктора или целлофанового бандажа.
Медикаментозную терапию проводят перед и после операции или при невозможности оперативного лечения. Цель консервативной терапии — снижение продукции и абсорбции токсичных для неровной системы токсинов. Консервативная терапия включает в себя: низкобелковую диету, антибиотики и лактулозу.
Хирургическое и консервативное лечение, увеличивают продолжительность жизни животных, однако собаки с врожденными портосистемными шунтами, которым провели операцию, имеют большую продолжительность жизни.
Основными осложнениями при хирургическом лечении ПСШ являются: судороги, портальная гипертензия, гипогликемия и сохранение клинических симптомов.
Несмотря на операционные риски, прогноз при хирургическом лечении портосистемных шунтов, в целом, хороший для собак и осторожный для кошек.
Список используемой литературы
Полные версии статьей можно найти на сайте — PubMed.
Konstantinidis AO, Adamama-Moraitou KK, Patsikas MN, Papazoglou LG. Congenital Portosystemic Shunts in Dogs and Cats: Treatment, Complications and Prognosis. Vet Sci. 2023 May 12;10(5):346.
- Weisse, C.; Berent, A. Hepatic Vascular Anomalies. In Textbook of Veterinary Internal Medicine; Ettinger, S., Feldman, E., Cote, E., Eds.; Elsevier: St. Louis, MO, USA, 2017; pp. 1639–1658.
- Berent, A.; Tobias, K. Hepatic Vascular Anomalies. In Veterinary Surgery: Small Animal; Johnston, S., Tobias, K., Eds.; Elsevier: St. Louis, MO, USA, 2018; pp. 1852–1885.
- Mehl, M.L.; Kyles, A.E.; Hardie, E.M.; Kass, P.H.; Adin, C.; Flynn, A.K.; De Cock, H.E.; Gregory, C.R. Evaluation of Ameroid Ring Constrictors for Treatment for Single Extrahepatic Portosystemic Shunts in Dogs: 168 Cases (1995–2001). J. Am. Vet. Med. Assoc. 2005, 226, 2020–2030.
- Bostwick, D.R.; Twedt, D.C. Intrahepatic and Extrahepatic Portal Venous Anomalies in Dogs: 52 Cases (1982–1992). J. Am. Vet. Med. Assoc. 1995, 206, 1181–1185.
- Weisse, C.; Berent, A.C.; Todd, K.; Solomon, J.A.; Cope, C. Endovascular Evaluation and Treatment of Intrahepatic Portosystemic Shunts in Dogs: 100 Cases (2001–2011). J. Am. Vet. Med. Assoc. 2014, 244, 78–94.
- Tobias, K.M.; Rohrbach, B.W. Association of Breed with the Diagnosis of Congenital Portosystemic Shunts in Dogs: 2,400 Cases (1980–2002). J. Am. Vet. Med. Assoc. 2003, 223, 1636–1639.
- Holford, A.L.; Tobias, K.M.; Bartges, J.W.; Johnson, B.M. Adrenal Response to Adrenocorticotropic Hormone in Dogs before and after Surgical Attenuation of a Single Congenital Portosystemic Shunt. J. Vet. Intern. Med. 2008, 22, 832–838.
- Berent, A.C.; Tobias, K.M. Portosystemic Vascular Anomalies. Vet. Clin. N. Am. Small Anim. Pract. 2009, 39, 513–541. [CrossRef]
- Tivers, M.; Lipscomb, V. Congenital Portosystemic Shunts in Cats: Investigation, Diagnosis and Stabilisation. J. Feline Med. Surg. 2011, 13, 173–184.
- Bayton, W.A.; Westgarth, C.; Scase, T.; Price, D.J.; Bexfield, N.H. Histopathological Frequency of Feline Hepatobiliary Disease in the UK. J. Small Anim. Pract. 2018, 59, 404–410.
- Winkler, J.T.; Bohling, M.W.; Tillson, M.D.; Wright, J.C.; Ballagas, A.J. Portosystemic Shunts: Diagnosis, Prognosis, and Treatment of 64 Cases (1993–2001). J. Am. Anim. Hosp. Assoc. 2003, 39, 169–185.
- Greenhalgh, S.N.; Dunning, M.D.; McKinley, T.J.; Goodfellow, M.R.; Kelman, K.R.; Freitag, T.; O’Neill, E.J.; Hall, E.J.; Watson, P.J.; Jeffery, N.D. Comparison of Survival after Surgical or Medical Treatment in Dogs with a Congenital Portosystemic Shunt. J. Am. Vet. Med. Assoc. 2010, 236, 1215–1220.
- Greenhalgh, S.N.; Reeve, J.A.; Johnstone, T.; Goodfellow, M.R.; Dunning, M.D.; O’Neill, E.J.; Hall, E.J.; Watson, P.J.; Jeffery, N.D. Long-Term Survival and Quality of Life in Dogs with Clinical Signs Associated with a Congenital Portosystemic Shunt after Surgical or Medical Treatment. J. Am. Vet. Med. Assoc. 2014, 245, 527–533.
- Zwingenberger, A.L.; Daniel, L.; Steffey, M.A.; Mayhew, P.D.; Mayhew, K.N.; Culp, W.T.N.; Hunt, G.B. Correlation Between Liver Volume, Portal Vascular Anatomy, and Hepatic Perfusion in DogsWith Congenital Portosystemic Shunt Before and After Placement of Ameroid Constrictors. Vet. Surg. 2014, 43, 926–934.
- Watson, P.J.; Herrtage, M.E. Medical Management of Congenital Portosystemic Shunts in 27 Dogs-a Retrospective Study. J. Small Anim. Pract. 1998, 39, 62–68.
- Tivers, M.S.; Lipscomb, V.J. Hepatic Vascular Disorders. In Feline Gastroenterology; Procoli, F., Allenspach, K.A., Salavati Schmitz, S., Eds.; Edra S.p.A.: Milano, Italy, 2021; pp. 346–359.
- Tivers, M.S.; Lipscomb, V.J.; Brockman, D.J. Treatment of Intrahepatic Congenital Portosystemic Shunts in Dogs: A Systematic Review. J. Small Anim. Pract. 2017, 58, 485–494.
- Gow, A.G. Hepatic Encephalopathy. Vet. Clin. N. Am.—Small Anim. Pract. 2017, 47, 585–599.
- Center, S.A. Nutritional Support for Dogs and Cats with Hepatobiliary Disease. J. Nutr. 1998, 128, 2733S–2746S.
- Laflamme, D.P. Nutritional Management of Liver Disease. In Kirk’s Current Veterinary Therapy XIII; Bonagura, J.D., Ed.; WB
Saunders: Philadelphia, PA, USA, 2000; pp. 693–697. - Laflamme, D.P.; Allen, S.W.; Huber, T.L. Apparent Dietary Protein Requirement of Dogs with Portosystemic Shunt. Am. J. Vet. Res. 1993, 54, 719–723.
- Lidbury, J.A.; Cook, A.K.; Steiner, J.M. Hepatic Encephalopathy in Dogs and Cats. J. Vet. Emerg. Crit. Care (San Antonio) 2016, 26, 471–487.
- Proot, S.; Biourge, V.; Teske, E.; Rothuizen, J. Soy Protein Isolate versus Meat-Based Low-Protein Diet for Dogs with Congenital Portosystemic Shunts. J. Vet. Intern. Med. 2009, 23, 794–800.
- Marks, S.L. Nutritional Management of Hepatobiliary Diseases. In Applied Veterinary Clinical Nutrition; Fascetti, A.J., Delaney, S.J., Eds.; Blackwell Publishing: Hoboken, NJ, USA, 2012; pp. 235–250.
- Elwir, S.; Rahimi, R.S. Hepatic Encephalopathy: An Update on the Pathophysiology and Therapeutic Options. J. Clin. Transl. Hepatol. 2017, 5, 142.
- Gerber, T.; Schomerus, H. Hepatic Encephalopathy in Liver Cirrhosis: Pathogenesis, Diagnosis and Management. Drugs 2000, 60, 1353–1370.
- Liu, A.; Perumpail, R.B.; Kumari, R.; Younossi, Z.M.; Wong, R.J.; Ahmed, A. Advances in Cirrhosis: Optimizing the Management of Hepatic Encephalopathy. World J. Hepatol. 2015, 7, 2871–2879.
- Phongsamran, P.V.; Kim, J.W.; Cupo Abbott, J.; Rosenblatt, A. Pharmacotherapy for Hepatic Encephalopathy. Drugs 2010, 70, 1131–1148.
- Serrano, G.; Devriendt, N.; de Rooster, H.; Paepe, D. Comparison of Diet, Lactulose, and Metronidazole Combinations in the Control of Pre-Surgical Clinical Signs in Dogs with Congenital Extrahepatic Portosystemic Shunts. J. Vet. Intern. Med. 2022, 36, 1258–1266.
- Bass, N.M.; Mullen, K.D.; Sanyal, A.; Poordad, F.; Neff, G.; Leevy, C.B. Sigal, S.; Sheikh, M.Y.; Beavers, K.; Frederick, T.; et al. Rifaximin Treatment in Hepatic Encephalopathy. N. Engl. J. Med. 2010, 362, 1071–1081.
- Miglio, F.; Valpiani, D.; Rossellini, S.R.; Ferrieri, A.; Canova, N. Rifaximin, a Non-Absorbable Rifamycin, for the Treatment of Hepatic Encephalopathy. A Double-Blind, Randomised Trial. Curr. Med. Res. Opin. 1997, 13, 593–601.
- Falls, E.L.; Milovancev, M.; Hunt, G.B.; Daniel, L.; Mehl, M.L.; Schmiedt, C.W. Long-Term Outcome after Surgical Ameroid Ring Constrictor Placement for Treatment of Single Extrahepatic Portosystemic Shunts in Dogs. Vet. Surg. 2013, 42, 951–957.
- Case, J.B.; Marvel, S.J.; Stiles, M.C.; Maisenbacher, H.W.; Toskich, B.B.; Smeak, D.D.; Monnet, E.L. Outcomes of Cellophane Banding or Percutaneous Transvenous Coil Embolization of Canine Intrahepatic Portosystemic Shunts. Vet. Surg. 2018, 47, O59–O66.
- Kraun, M.B.; Nelson, L.L.; Hauptman, J.G.; Nelson, N.C. Analysis of the Relationship of Extrahepatic Portosystemic Shunt Morphology with Clinical Variables in Dogs: 53 Cases (2009–2012). J. Am. Vet. Med. Assoc. 2014, 245, 540–549.
- Häussinger, D.; Butz, M.; Schnitzler, A.; Görg, B. Pathomechanisms in Hepatic Encephalopathy. Biol. Chem. 2021, 402, 1087–1102.
- Basile, A.S.; Hughes, R.D.; Harrison, P.M.; Murata, Y.; Pannell, L.; Jones, E.A.; Williams, R.; Skolnick, P. Elevated Brain Concentrations of 1,4-Benzodiazepines in Fulminant Hepatic Failure. N. Engl. J. Med. 1991, 325, 473–478.
- Bakti, G.; Fisch, H.U.; Karlaganis, G.; Minder, C.; Bircher, J. Mechanism of the Excessive Sedative Response of Cirrhotics to Benzodiazepines: Model Experiments with Triazolam. Hepatology 1987, 7, 629–638.
- Ahboucha, S.; Butterworth, R.F. The Neurosteroid System: Implication in the Pathophysiology of Hepatic Encephalopathy. Neurochem. Int. 2008, 52, 575–587. [CrossRef]
- Amrein, R.; Leishman, B.; Bentzinger, C.; Roncari, G. Flumazenil in Benzodiazepine Antagonism. Actions and Clinical Use in Intoxications and Anaesthesiology. Med. Toxicol. Adverse Drug Exp. 1987, 2, 411–429.
- Goulenok, C.; Bernard, B.; Cadranel, J.F.; Thabut, D.; Di Martino, V.; Opolon, P.; Poynard, T. Flumazenil vs. Placebo in Hepatic Encephalopathy in Patients with Cirrhosis: A Meta-Analysis. Aliment. Pharmacol. Ther. 2002, 16, 361–372.
- Meyer, H.P.; Legemate, D.A.; Van Den Brom, W.; Rothuizen, J. Improvement of Chronic Hepatic Encephalopathy in Dogs by the Benzodiazepine-Receptor Partial Inverse Agonist Sarmazenil, but Not by the Antagonist Flumazenil. Metab. Brain Dis. 1998, 13, 241–251.
- Lipscomb, V.J.; Lee, K.C.; Lamb, C.R.; Brockman, D.J. Association of Mesenteric Portovenographic Findings with Outcome in Cats Receiving Surgical Treatment for Single Congenital Portosystemic Shunts. J. Am. Vet. Med. Assoc. 2009, 234, 221–228.
- Lee, K.C.L.; Lipscomb, V.J.; Lamb, C.R.; Gregory, S.P.; Guitian, J.; Brockman, D.J. Association of Portovenographic Findings with Outcome in Dogs Receiving Surgical Treatment for Single Congenital Portosystemic Shunts: 45 Cases (2000–2004). J. Am. Vet. Med. Assoc. 2006, 229, 1122–1129.
- Kummeling, A.; Vrakking, D.J.E.; Rothuizen, J.; Gerritsen, K.M.; van Sluijs, F.J. Hepatic Volume Measurements in Dogs with Extrahepatic Congenital Portosystemic Shunts before and after Surgical Attenuation. J. Vet. Intern. Med. 2010, 24, 114–119.
- Hunt, G.B.; Culp,W.T.N.; Mayhew, K.N.; Mayhew, P.; Steffey, M.A.; Zwingenberger, A. Evaluation of in Vivo Behavior of Ameroid Ring Constrictors in Dogs with Congenital Extrahepatic Portosystemic Shunts Using Computed Tomography. Vet. Surg. 2014, 43, 834–842.
- Tivers, M.S.; Lipscomb, V.J.; Smith, K.C.; Wheeler-Jones, C.P.D.; House, A.K. Markers of Hepatic Regeneration Associated with Surgical Attenuation of Congenital Portosystemic Shunts in Dogs. Vet. J. 2014, 200, 305–311.
- Adin, C.A.; Sereda, C.W.; Thompson, M.S.; Wheeler, J.L.; Archer, L.L. Outcome Associated with Use of a Percutaneously Controlled Hydraulic Occluder for Treatment of Dogs with Intrahepatic Portosystemic Shunts. J. Am. Vet. Med. Assoc. 2006, 229, 1749–1755.
- Frankel, D.; Seim, H.; MacPhail, C.; Monnet, E. Evaluation of Cellophane Banding with and without Intraoperative Attenuation for Treatment of Congenital Extrahepatic Portosystemic Shunts in Dogs. J. Am. Vet. Med. Assoc. 2006, 228, 1355–1360.
- Kummeling, A.; Van Sluijs, F.J.; Rothuizen, J. Prognostic Implications of the Degree of Shunt Narrowing and of the Portal Vein Diameter in Dogs with Congenital Portosystemic Shunts. Vet. Surg. 2004, 33, 17–24.
- Sereda, C.W.; Adin, C.A. Methods of Gradual Vascular Occlusion and Their Applications in Treatment of Congenital Portosystemic Shunts in Dogs: A Review. Vet. Surg. 2005, 34, 83–91.
- Hunt, G.B.; Kummeling, A.; Tisdall, P.L.C.; Marchevsky, A.M.; Liptak, J.M.; Youmans, K.R.; Goldsmid, S.E.; Beck, J.A. Outcomes of Cellophane Banding for Congenital Portosystemic Shunts in 106 Dogs and 5 Cats. Vet. Surg. 2004, 33, 25–31.
- Lipscomb, V.J.; Jones, H.J.; Brockman, D.J. Complications and Long Term Outcomes of the Ligation of Congenital Portosystemic Shunts in 49 Cats. Vet. Rec. 2007, 160, 465–470.
- Swalec, K.M.; Smeak, D.D. Partial versus Complete Attenuation of Single Portosystemic Shunts. Vet. Surg. 1990, 19, 406–411.
- Hottinger, H.A.; Walshaw, R.; Hauptman, J.G. Long-Term Results of Complete and Partial Ligation of Congenital Portosystemic Shunts in Dogs. Vet. Surg. 1995, 24, 331–336.
- Hunt, G.B.; Hughes, J. Outcomes after Extrahepatic Portosystemic Shunt Ligation in 49 Dogs. Aust. Vet. J. 1999, 77, 303–307.
- Hunt, G.B.; Bellenger, C.R.; Pearson, M.R.B. Transportal Approach for Attenuating Intrahepatic Portosystemic Shunts in Dogs. Vet. Surg. 1996, 25, 300–308.
- White, R.N.; Burton, C.A.; McEvoy, F.J. Surgical Treatment of Intrahepatic Portosystemic Shunts in 45 Dogs. Vet. Rec. 1998, 142, 358–365.
- Bertolini, G.; Rolla, E.C.; Zotti, A.; Caldin, M. Three-Dimensional Multislice Helical Computed Tomography Techniques for Canine Extra-Hepatic Portosystemic Shunt Assessment. Vet. Radiol. Ultrasound 2006, 47, 439–443.
- Bertolini, G. Anomalies of the Portal Venous System in Dogs and Cats as Seen on Multidetector-Row Computed Tomography: An Overview and Systematization Proposal. Vet. Sci. 2019, 6, 10.
- Parker, J.S.; Monnet, E.; Powers, B.E.; Twedt, D.C. Histologic Examination of Hepatic Biopsy Samples as a Prognostic Indicator in Dogs Undergoing Surgical Correction of Congenital Portosystemic Shunts: 64 Cases (1997–2005). J. Am. Vet. Med. Assoc. 2008, 232, 1511–1514.
- van Gundy, T.E.; Boothe, H.W.; Wolf, A. Results of Surgical Management of Feline Portosystemic Shunts. J. Am. Anim. Hosp. Assoc. 1990, 26, 55–62.
- Levy, J.; Bunch, S.; Komtebedde, J. Feline Portosystemic Vascular Shunts. In Kirk’s Current Veterinary Therapy XII Small Animal Practice; Bonagura, J., Ed.; WB Saunders: Philadelphia, PA, USA, 1995; pp. 915–919.
- Kyles, A.E.; Gregory, C.R.; Jackson, J.; Ilkiw, J.E.; Pascoe, P.J.; Adin, C.; Samii, V.F.; Herrgesell, E. Evaluation of a Portocaval Venograft and Ameroid Ring for the Occlusion of Intrahepatic Portocaval Shunts in Dogs. Vet. Surg. 2001, 30, 161–169.
- Papazoglou, L.G.; Monnet, E.; Seim, H.B. Survival and Prognostic Indicators for Dogs with Intrahepatic Portosystemic Shunts: 32 Cases (1990–2000). Vet. Surg. 2002, 31, 561–570.
- Tivers, M.S.; Lipscomb, V.J.; Bristow, P.; Brockman, D.J. Intrahepatic Congenital Portosystemic Shunts in Dogs: Short- and Long-Term Outcome of Suture Attenuation. J. Small Anim. Pract. 2018, 59, 201 210.
- Breznock, E.M. Surgical Manipulation of Portosystemic Shunts in Dogs. J. Am. Vet. Med. Assoc. 1979, 174, 819–826.
- Martin, R.A.; Freeman, L.E. Identification and Surgical Management of Portosystemic Shunts in the Dog and Cat. Semin. Vet. Med. Surg. (Small Anim.) 1987, 2, 302–306.
- Swalec, K.M.; Smeak, D.D.; Brown, J. Effects of Mechanical and Pharmacologic Manipulations on Portal Pressure, Central Venous Pressure, and Heart Rate in Dogs. Am. J. Vet. Res. 1991, 52, 1327–1335.
- Peterson, S.L.; Gregory, C.R.; Snyder, J.R.; Whiting, P.G.; Strack, D.; Breznock, E.M. Splanchnic Surface Oximetry during Experimental Portal Hypertension and Surgical Manipulation of Portosystemic Shunts in Dogs. Vet. Surg. 1991, 20, 164–168.
- White, R.N.; MacDonald, N.J.; Burton, C.A. Use of Intraoperative Mesenteric Portovenography in Congenital Portosystemic Shunt Surgery. Vet. Radiol. Ultrasound 2003, 44, 514–521.
- Buob, S.; Johnston, A.N.; Webster, C.R. Portal Hypertension: Pathophysiology, Diagnosis, and Treatment. J. Vet. Intern. Med. 2011, 25, 169–186.
- Mathews, K.; Gofton, N. Congenital Extrahepatic Portosystemic Shunt Occlusion in the Dog: Gross Observations during Surgical Correction. J. Am. Anim. Hosp. Assoc. 1988, 24, 387–394.
- Burton, C.A.; White, R.N. Portovenogram Findings in Cases of Elevated Bile Acid Concentrations Following Correction of Portosystemic Shunts. J. Small Anim. Pract. 2001, 42, 536–540.
- Kayanuma, H.; Koyama, R.; Kanai, E. Feasibility of Complete Surgical Ligation on 72 Dogs with Singular Extrahepatic Congenital Portosystemic Shunt Based on Portal Pressure and Comparison of Intraoperative Mesenteric Portovenography. J. Vet. Med. Sci.
2019, 81, 361–364. - Van Vechten, B.J.; Komtebedde, J.; Koblik, P.D. Use of Transcolonic Portal Scintigraphy to Monitor Blood Flow and Progressive Postoperative Attenuation of Partially Ligated Single Extrahepatic Portosystemic Shunts in Dogs. J. Am. Vet. Med. Assoc. 1994, 204, 1770–1774.
- Vogt, J.C.; Krahwinkel, D.J.; Bright, R.M.; Daniel, G.B.; Toal, R.L.; Rohrbach, B. Gradual Occlusion of Extrahepatic Portosystemic Shunts in Dogs and Cats Using the Ameroid Constrictor. Vet. Surg. 1996, 25, 495–502.
- Murphy, S.T.; Ellison, G.W.; Long, M.; Van Gilder, J. A Comparison of the Ameroid Constrictor versus Ligation in the Surgical Management of Single Extrahepatic Portosystemic Shunts. J. Am. Anim. Hosp. Assoc. 2001, 37, 390–396.
- Hurn, S.D.; Edwards, G.A. Perioperative Outcomes after Three Different Single Extrahepatic Portosystemic Shunt Attenuation Techniques in Dogs: Partial Ligation, Complete Ligation and Ameroid Constrictor Placement. Aust. Vet. J. 2003, 81, 666–670.
- Tobias, K. Portosystemic Shunts and Other Hepatic Vascular Anomalies. In Textbook of Small Animal Surgery; Slatter, D., Ed.; Saunders Elsevier: Philadelphia, PA, USA, 2003; pp. 727–751.
- Harari, J.; Lincoln, J.; Alexander, J.; Miller, J. Lateral Thoracotomy and Cellophane Handing of a Congenital Portoazygous Shunt in a Dog. J. Small Anim. Pract. 1990, 31, 571–573.
- Youmans, K.R.; Hunt, G.B. Cellophane Banding for the Gradual Attenuation of Single Extrahepatic Portosystemic Shunts in Eleven Dogs. Aust. Vet. J. 1998, 76, 531–537.
- Youmans, K.R.; Hunt, G.B. Experimental Evaluation of Four Methods of Progressive Venous Attenuation in Dogs. Vet. Surg. 1999, 28, 38–47.
- Landon, B.P.; Abraham, L.A.; Charles, J.A. Use of Transcolonic Portal Scintigraphy to Evaluate Efficacy of Cellophane Banding of Congenital Extrahepatic Portosystemic Shunts in 16 Dogs. Aust. Vet. J. 2008, 86, 169–179.
- Lawrence, D.; Bellah, J.R.; Diaz, R. Results of Surgical Management of Portosystemic Shunts in Dogs: 20 Cases (1985–1990). J. Am. Vet. Med. Assoc. 1992, 201, 1750–1753.
- Cabassu, J.; Seim, H.B.; MacPhail, C.M.; Monnet, E. Outcomes of Cats Undergoing Surgical Attenuation of Congenital Extrahepatic Portosystemic Shunts through Cellophane Banding: 9 Cases (2000 2007). J. Am. Vet. Med. Assoc. 2011, 238, 89–93.
- Matiasovic, M.; Chanoit, G.P.A.; Meakin, L.B.; Tivers, M.S. Outcomes of Dogs Treated for Extrahepatic Congenital Portosystemic Shunts with Thin Film Banding or Ameroid Ring Constrictor. Vet. Surg. 2020, 49, 160–171.
- Traverson, M.; Lussier, B.; Huneault, L.; Gatineau, M. Comparative Outcomes between Ameroid Ring Constrictor and Cellophane Banding for Treatment of Single Congenital Extrahepatic Portosystemic Shunts in 49 Dogs (1998–2012). Vet. Surg. 2018, 47, 179–187.
- Valiente, P.; Trehy, M.; White, R.; Nelissen, P.; Demetriou, J.; Stanzani, G.; de la Puerta, B. Complications and Outcome of Cats with Congenital Extrahepatic Portosystemic Shunts Treated with Thin Film: Thirty-Four Cases (2008–2017). J. Vet. Intern. Med. 2020, 34, 117–124.
- Otomo, A.; Singh, A.; Jeong, J.; Dobberstein, R.; Lundhild, A.; Peter, E.; Brisson, B.; Oblak, M.; Milovancev, M. Long-Term Clinical Outcomes of Dogs with Single Congenital Extrahepatic Portosystemic Shunts Attenuated with Thin Film Banding or Ameroid Ring Constrictors. Vet. Surg. 2020, 49, 436–444.
- Wallace, M.L.; Ellison, G.W.; Giglio, R.F.; Batich, C.D.; Berry, C.R.; Case, J.B.; Kim, S.E. Gradual Attenuation of a Congenital Extrahepatic Portosystemic Shunt with a Self-Retaining Polyacrylic Acid-Silicone Device in 6 Dogs. Vet. Surg. 2018, 47, 722–728.
- Partington, B.P.; Partington, C.R.; Biller, D.S.; Toshach, K. Transvenous Coil Embolization for Treatment of Patent Ductus Venosus in a Dog. J. Am. Vet. Med. Assoc. 1993, 202, 281–284.
- Leveille, R.; Pibarot, P.; Soulez, G.; Wisner, E.R. Transvenous Coil Embolization of an Extrahepatic Portosystemic Shunt in a Dog: A Naturally Occurring Model of Portosystemic Malformations in Humans. Pediatr. Radiol. 2000, 30, 607–609.
- Asano, K.; Watari, T.; Kuwabara, M.; Sasaki, Y.; Teshima, K.; Kato, Y.; Tanaka, S. Successful Treatment by Percutaneous Transvenous Coil Embolization in a Small-Breed Dog with Intrahepatic Portosystemic Shunt. J. Vet. Med. Sci. 2003, 65, 1269–1272.
- Leveille, R.; Johnson, S.E.; Birchard, S.J. Transvenous Coil Embolization of Portosystemic Shunt in Dogs. Vet. Radiol. Ultrasound 2003, 44, 32–36.
- Culp,W.T.N.; Zwingenberger, A.L.; Giuffrida, M.A.;Wisner, E.R.; Hunt, G.B.; Steffey, M.A.; Mayhew, P.D.; Marks, S.L. Prospective Evaluation of Outcome of Dogs with Intrahepatic Portosystemic Shunts Treated via Percutaneous Transvenous Coil Embolization. Vet. Surg. 2018, 47, 74–85.
- Schneider, M.; Plassmann, M.; Rauber, K. Intrahepatic Venous Collaterals Preventing Successful Stent-Supported Coil Embolization of Intrahepatic Shunts in Dogs. Vet. Radiol. Ultrasound 2009, 50, 376 384.
- Gonzalo, J.M. Portosystemic Shunt in a Dog. Am. J. Vet. Res. 2000, 41, 516–518.
- Bussadori, R.; Bussadori, C.; Milla, L.; Rodrı, A.; Gonzalo-orden, M. Transvenous Coil Embolisation for the Treatment of Single Congenital Portosystemic Shunts in Six Dogs. Vet. J. 2008, 176, 221–226.
- Tivers, M.S.; Upjohn, M.M.; House, A.K.; Brockman, D.J.; Lipscomb, V.J. Treatment of Extrahepatic Congenital Portosystemic Shunts in Dogs—What Is the Evidence Base? J. Small Anim. Pract. 2012, 53, 3–11.
- Serrano, G.; Charalambous, M.; Devriendt, N.; de Rooster, H.; Mortier, F.; Paepe, D. Treatment of Congenital Extrahepatic Portosystemic Shunts in Dogs: A Systematic Review and Meta-Analysis. J. Vet. Intern. Med. 2019, 33, 1865–1879.
- Wolschrijn, C.F.; Mahapokai, W.; Rothuizen, J.; Meyer, H.P.; van Sluijs, F.J. Gauged Attenuation of Congenital Portosystemic Shunts: Results in 160 Dogs and 15 Cats. Vet. Q. 2000, 22, 94–98.
- Holt, D. Critical Care Management of the Portosystemic Shunt Patient. Compend. Contin. Educ. Pract. Vet. 1994, 16, 879–892.
- Brunson, B.W.; Case, J.B.; Ellison, G.W.; Fox-Alvarez, W.A.; Kim, S.E.; Winter, M.; Garcia-Pereira, F.L.; Farina, L.L. Evaluation of Surgical Outcome, Complications, and Mortality in Dogs Undergoing Preoperative Computed Tomography Angiography for Diagnosis of an Extrahepatic Portosystemic Shunt: 124 Cases (2005–2014). Can. Vet. J. 2016, 57, 59.
- Tisdall, P.L.; Hunt, G.B.; Youmans, K.R.; Malik, R. Neurological Dysfunction in Dogs Following Attenuation of Congenital Extrahepatic Portosystemic Shunts. J. Small Anim. Pract. 2000, 41, 539–546.
- Fryer, K.J.; Levine, J.M.; Peycke, L.E.; Thompson, J.A.; Cohen, N.D. Incidence of Postoperative Seizures with and without Levetiracetam Pretreatment in Dogs Undergoing Portosystemic Shunt Attenuation. J. Vet. Intern. Med. 2011, 25, 1379–1384.
- Hardie, E.M.; Kornegay, J.N.; Cullen, J.M. Status Epilepticus after Ligation of Portosystemic Shunts. Vet. Surg. 1990, 19, 412–417.
- Kyles, A.E.; Hardie, E.M.; Mehl, M.; Gregory, C.R. Evaluation of Ameroid Ring Constrictors for the Management of Single Extrahepatic Portosystemic Shunts in Cats: 23 Cases (1996–2001). J. Am. Vet. Med. Assoc. 2002, 220, 1341–1347.
- Havig, M.; Tobias, K.M. Outcome of Ameroid Constrictor Occlusion of Single Congenital Extrahepatic Portosystemic Shunts in Cats: 12 Cases (1993–2000). J. Am. Vet. Med. Assoc. 2002, 220, 337–341.
- Strickland, R.; Tivers, M.S.; Fowkes, R.C.; Lipscomb, V.J. Incidence and Risk Factors for Neurological Signs after Attenuation of a Single Congenital Portosystemic Shunt in 50 Cats. Vet. Surg. 2021, 50, 303 311.
- Mullins, R.A.; Sanchez Villamil, C.; Selmic, L.E.; Tivers, M.S.; Case, J.B.; Singh, A.; Thieman Mankin, K.M.; Anderson, D.M.; White, R.N.; Pratschke, K.M.; et al. Prognostic Factors for Short-Term Survival of Dogs That Experience Postattenuation Seizures after Surgical Correction of Single Congenital Extrahepatic Portosystemic Shunts: 93 Cases (2005–2018). Vet. Surg. 2020, 49, 958–970.
- Strickland, R.; Tivers, M.S.; Adamantos, S.E.; Harcourt-Brown, T.R.; Fowkes, R.C.; Lipscomb, V.J. Incidence and Risk Factors for Neurological Signs after Attenuation of Single Congenital Portosystemic Shunts in 253 Dogs. Vet. Surg. 2018, 47, 745–755.
- Yool, D.A.; Kirby, B.M. Neurological Dysfunction in Three Dogs and One Cat Following Attenuation of Intrahepatic Portosystemic Shunts. J. Small Anim. Pract. 2002, 43, 171–176. [CrossRef]
- Aronson, L.R.; Gacad, R.C.; Kaminsky-Russ, K.; Gregory, C.R.; Mullen, K.D. Endogenous Benzodiazepine Activity in the Peripheral and Portal Blood of Dogs with Congenital Portosystemic Shunts. Vet. Surg. 1997, 26, 189–194.
- Torisu, S.; Washizu, M.; Hasegawa, D.; Orima, H. Sustained Severe Hypoglycemia during Surgery as a Genesis of Global Brain Damage in Post Ligation Seizure of Congenital Portosystemic Shunts Dogs. In Proceedings of the Research Abstract Program of the 24th Annual ACVIM Forum, Louisville, KY, USA, 31 May–3 June 2006; p. 753.
- Wallace, M.L.; MacPhail, C.M.; Monnet, E. Incidence of Postoperative Neurologic Complications in Pugs Following Portosystemic Shunt Attenuation Surgery. J. Am. Anim. Hosp. Assoc. 2018, 54, 46–49.
- Mullins, R.A.; Sanchez Villamil, C.; de Rooster, H.; Kummeling, A.; White, R.N.; Thieman Mankin, K.M.; Tivers, M.S.; Yool, D.A.; Anderson, D.M.; Pratschke, K.M.; et al. Effect of Prophylactic Treatment with Levetiracetam on the Incidence of Postattenuation Seizures in Dogs Undergoing Surgical Management of Single Congenital Extrahepatic Portosystemic Shunts. Vet. Surg. 2019, 48, 164–172.
- Matushek, K.; Bjorling, D.; Mathews, K. Generalized Motor Seizures after Portosystemic Shunt Ligation in Dogs: Five Cases (1981–1988). J. Am. Vet. Med. Assoc. 1990, 196, 2014–2017.
- Gommeren, K.; Claeys, S.; de Rooster, H.; Hamaide, A.; Daminet, S. Outcome from Status Epilepticus after Portosystemic Shunt Attenuation in 3 Dogs Treated with Propofol and Phenobarbital. J. Vet. Emerg. Crit. Care 2010, 20, 346–351.
- Hunt, G.B. Effect of Breed on Anatomy of Portosystemic Shunts Resulting from Congenital Diseases in Dogs and Cats: A Review of 242 Cases. Aust. Vet. J. 2004, 82, 746–749.
- Nelson, N.C.; Nelson, L.L. Imaging and Clinical Outcomes in 20 Dogs Treated with Thin Film Banding for Extrahepatic Portosystemic Shunts. Vet. Surg. 2016, 45, 736–745.
- Vallarino, N.; Pil, S.; Devriendt, N.; Or, M.; Vandermeulen, E.; Serrano, G.; Paepe, D.; Bosmans, T.; De Rooster, H. Diagnostic Value of Blood Variables Following Attenuation of Congenital Extrahepatic Portosystemic Shunt in Dogs. Vet. Rec. 2020, 187, 48.
- van Straten, G.; Spee, B.; Rothuizen, J.; van Straten, M.; Favier, R.P. Diagnostic Value of the Rectal Ammonia Tolerance Test, Fasting Plasma Ammonia and Fasting Plasma Bile Acids for Canine Portosystemic Shunting. Vet. J. 2015, 204, 282–286.
- Devriendt, N.; Serrano, G.; Meyer, E.; Demeyere, K.; Paepe, D.; Vandermeulen, E.; Stock, E.; de Rooster, H. Serum Hyaluronic Acid, a Marker for Improved Liver Perfusion after Gradual Surgical Attenuation of Extrahepatic Portosystemic Shunt Closure in Dogs. Vet. J. 2021, 268, 105604.
- Devriendt, N.; Serrano, G.; Croubels, S.; Stock, E.; Vandermeulen, E.; Paepe, D.; von Luckner, J.; de Rooster, H. Evaluation of Serum Lidocaine/Monoethylglycylxylidide Concentration to Assess Shunt Closure in Dogs with Extrahepatic Portosystemic Shunts. J. Vet. Intern. Med. 2021, 35, 261–268.
- Serrano, G.; Devriendt, N.; Paepe, D.; de Rooster, H. Serum Insulin-like Growth Factor-1 as a Marker of Improved Liver Function and Surgical Outcome in Dogs with Congenital Extrahepatic Portosystemic Shunts. Vet. J. 2021, 274, 105716.
- Toulza, O.; Center, S.; Brooks, M.B.; Erb, H.N.;Warner, K.L.; Deal,W. Evaluation of Plasma Protein C Activity for Detection of Hepatobiliary Disease and Portosystemic Shunting in Dogs. J. Am. Vet. Med. Assoc. 2006, 229, 1761–1771.
- Bristow, P.; Lipscomb, V.; Kummeling, A.; Packer, R.; Gerrits, H.; Homan, K.; Ortiz, V.; Newson, K.; Tivers, M. Health-Related Quality of Life Following Surgical Attenuation of Congenital Portosystemic Shunts versus Healthy Controls. J. Small Anim. Pract. 2019, 60, 21–26.
- Szatmári, V.; Rothuizen, J.; van den Ingh, T.S.G. a M.; van Sluijs, F.J.; Voorhout, G. Ultrasonographic Findings in Dogs with Hyperammonemia: 90 Cases (2000–2002). J. Am. Vet. Med. Assoc. 2004, 224, 717–727.
- Sura, P.A.; Tobias, K.M.; Morandi, F.; Daniel, G.B.; Echandi, R.L. Comparison of 99mTcO4(-) Trans-Splenic Portal Scintigraphy with per-Rectal Portal Scintigraphy for Diagnosis of Portosystemic Shunts in Dogs. Vet. Surg. 2007, 36, 654–660.
- Bunch, S.E.; Johnson, S.E.; Cullen, J.M. Idiopathic Noncirrhotic Portal Hypertension in Dogs: 33 Cases (1982–1998). J. Am. Vet. Med. Assoc. 2001, 218, 392–399.
- Anglin, E.V.; Lux, C.N.; Sun, X.; Folk, C.A.; Fazio, C. Clinical Characteristics of, Prognostic Factors for, and Long-Term Outcome of Dogs with Multiple Acquired Portosystemic Shunts: 72 Cases (2000 2018). J. Am. Vet. Med. Assoc. 2022, 260, S30–S39.
- Ricciardi, M. Unusual Haemodynamics in Two Dogs and Two Cats with Portosystemic Shunt—Implications for Distinguishing between Congenital and Acquired Conditions. Open Vet. J. 2017, 7, 86.
- Agg, E.J. Acquired Extrahepatic Portosystemic Shunts in a Young Dog. Can. Vet. J. 2006, 47, 697.
- Boothe, H.W.; Howe, L.M.; Edwards, J.F.; Slater, M.R. Multiple Extrahepatic Portosystemic Shunts in Dogs: 30 Cases (1981–1993). J. Am. Vet. Med. Assoc. 1996, 208, 1849–1854.
- Worley, D.R.; Holt, D.E. Clinical Outcome of Congenital Extrahepatic Portosystemic Shunt Attenuation in Dogs Aged Five Years and Older: 17 Cases (1992–2005). J. Am. Vet. Med. Assoc. 2008, 232, 722–727.
- Szatmári, V.; van Sluijs, F.J.; Rothuizen, J.; Voorhout, G. Intraoperative Ultrasonography of the Portal Vein during Attenuation of Intrahepatic Portocaval Shunts in Dogs. J. Am. Vet. Med. Assoc. 2003, 222, 1086 1092.
- Bright, S.R.;Williams, J.M.; Niles, J.D. Outcomes of Intrahepatic Portosystemic Shunts Occluded with Ameroid Constrictors in Nine Dogs and One Cat. Vet. Surg. 2006, 35, 300–309.
- Mehl, M.L.; Kyles, A.E.; Case, J.B.; Kass, P.H.; Zwingenberger, A.; Gregory, C.R. Surgical Management of Left-Divisional Intrahepatic Portosystemic Shunts: Outcome after Partial Ligation of, or Ameroid Ring Constrictor Placement on, the Left Hepatic Vein in Twenty-Eight Dogs (1995–2005). Vet. Surg. 2007, 36, 21–30.
- Weisse, C.; Schwartz, K.; Stronger, R.; Mondschein, J.I.; Solomon, J.A. Transjugular Coil Embolization of an Intrahepatic Portosystemic Shunt in a Cat. J. Am. Vet. Med. Assoc. 2002, 221, 1287–1291.
- Palerme, J.S.; Brown, J.C.; Marks, S.L.; Birkenheuer, A.J. Splenosystemic Shunts in Cats: A Retrospective of 33 Cases (2004 2011). J. Vet. Intern. Med. 2013, 27, 1347–1353.