Мукоцеле желчного пузыря (МЖП) у собак — патологическое скопление застойной желчи и слизи в полости желчного пузыря (рисунок 1).
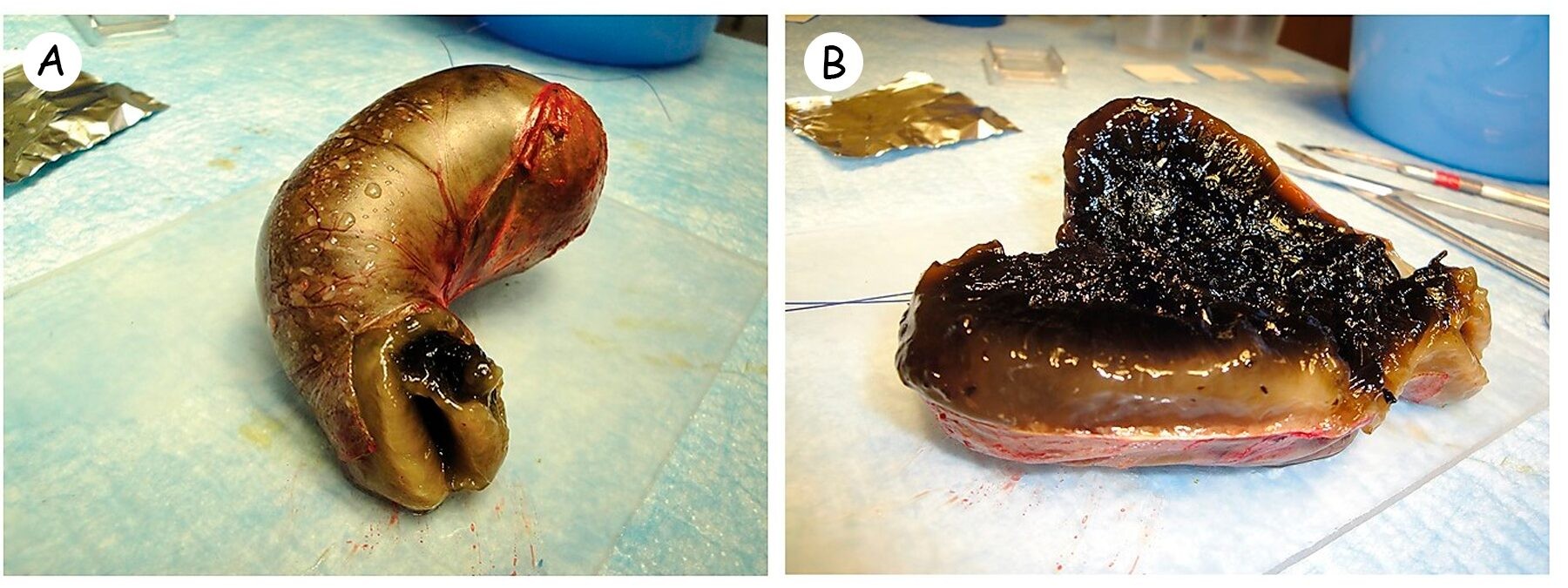
Рисунок 1. (A) Удаленный желчный пузырь у собаки с мукоцеле; (B) Желчный пузырь после вскрытия, обратите внимание на его переполнение густой темно-коричневой желчью.
Оглавление
Введение
Мукоцеле желчного пузыря (МЖП) является относительно частой патологией желчевыводящих путей у собак (Aguirre et al. 2007; Quinn & Cook 2009). МЖП редко встречается у кошек, в мировой литературе описано всего несколько случаев (Bennett et al. 2007; Woods et al. 2012).
Под мукоцеле подразумевают скопление застойной желчи со слизью внутри желчного пузыря, что приводит к его переполнению густым темно-коричневым содержимым (рисунок 1), которое в дальнейшем может заполнять желчные протоки и приводить к обструкции желчевыводящей системы. Нарушение оттока желчи приводит к некрозу или перфорации желчного пузыря с развитием перитонита.
Характерная картина мукоцеле при проведении ультразвукового исследования в сочетании с анамнезом, клиническим осмотром и результатами биохимического анализа крови, делают постановку диагноза относительно простой. Часто у собак с мукоцеле желчного пузыря есть сопутствующие патологии: панкреатит, гиперлипидемия, гиперадренокортицизм, гипотиреоидизм, нефропатия с потерей белка, сахарный диабет и холелитиаз (Aguirre et al. 2007).
Основным лечением является удаление желчного пузыря, однако в определенных случаях, допустима медикаментозная терапия.
Анатомия желчевыводящей системы собаки
Желчный пузырь находится в правом краниальном квадранте брюшной полости, имеет грушевидную форму, распологается в желчной ямке между квадратной и правой медиальной долями печени. Желчный пузырь состоит из дна, тела и шейки от которой отходит короткий пузырный проток, впадающий в общий желчный проток (рисунок 2).
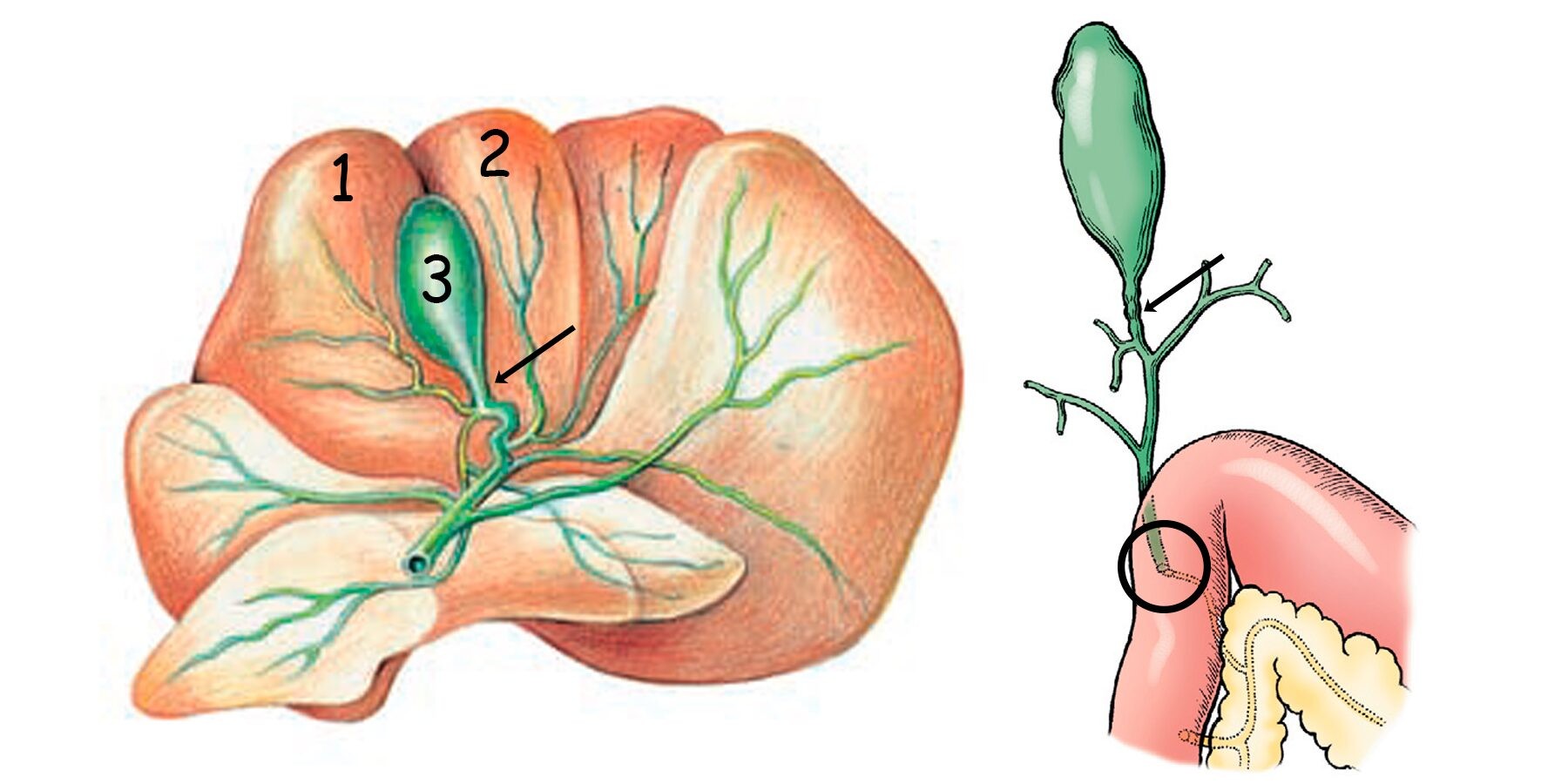
Рисунок 2. Анатомия желчевыводящей системы у собаки: (1) правая медиальная доля печени; (2) квадратная доля печени; (3) желчный пузырь; пузырный проток (стрелка) и место впадения общего желчного протока в двенадцатиперстную кишку (круг).
Стенка желчного пузыря состоит из 5 слоев (Quinn & Cook 2009):
- эпителиальный
- подслизистый (lamina propria и tunica submucosa)
- мышечный (tunica muscularis externa)
- серозный (tunica serosa)
- адвентициальный (tinica adventitia)
Кровоток обеспечивается только за счет пузырной артерии, что делает возможным развитие ишемического некроза желчного пузыря при обструкции этого сосуда.
Основной функцией желчного пузыря является накопление желчи, где она может концентрироваться, закисляться (за счет секреции эпителием кислот) и модифицироваться (путем добавления муцина и иммуноглобулинов), перед поступлением в двенадцатиперстную кишку через большой сосочек двенадцатиперстной кишки.
Желчный пузырь не является жизненно необходимым органом, поэтому его удаление хорошо переносится у большинства животных, включая собак.
Этиология и факторы риска развития мукоцеле у собак
Этиология развития мукоцеле у собак до конца не изучена, но она является комплексной и многофакторной (Norwich 2011).
Некоторые эндокринные заболевания (гиперадренокортицизм, гипотиреоз, но не сахарный диабет) могут приводить к развитию мукоцеле (Meler & Pressler 2010). В одном исследовании, у собак с гиперадренокортицизмом в 29 раз чаще отмечались признаки МЖП и в группе животных с диагнозом мукоцеле, у 21% выявили гиперадренокортицизм (Mesich et al. 2009). В другом исследовании у 23% собак с МЖП диагностировали гиперадренокортицизм (Pike et al. 2004).
В одном экспериментальном исследовании, собакам вводили гидрокортизон в течение 84 суток с целью симуляции гиперадренокортицизма (Kook et al. 2011, 2012). По результату исследования, не была выявлена разница в частоте развития мукоцеле желчного пузыря по сравнению с контрольной группой. Однако у собак с ятрогенным гиперадренокортицизмом изменился состав желчи — увеличилась концентрация цитотоксичных, гидрофобных и неконъюгированных желчных кислот. Эти желчные кислоты стимулируют продукцию муцина эпителием желчного пузыря (Klinkspoor et al. 1995). Такие цитотоксические изменения в составе желчных кислот у собак с гиперадренокортицизмом, могут быть причиной нарушения функции желчного пузыря и предрасполагать к развитию мукоцеле. Есть также гипотеза о том, что гиперадренокортицизм может повышать риски развития бактериального холецистита из-за иммуносупрессивного действия гормонов надпочечников (Mesich et al. 2009).
У собак с гипотиреозом в три раза чаще встречается мукоцеле желчного пузыря по сравнению с животными с нормальной функцией щитовидной железы. Тироксин стимулирует релаксацию сфинктера Одди в большом сосочке двенадцатиперстной кишки у людей и свиней (Laukkarinen et al. 2002). Дефицит тироксина повышает тонус сфинктера Одди, что в свою очередь приводит к замедленной эвакуации желчи. Застой концентрированной желчи раздражает эпителий желчного пузыря и стимулирует выработку слизи. Тироксин также меняет состав желчных кислот, что может играть дополнительную роль в развитии МЖП (Meler & Pressler 2010; Mesich et al. 2009).
Дислипидемия (из-за гипотиреоидизма, гиперадренокортицизма или идиопатическая) связана с развитием МЖП, что может быть связано с усиленной конверсией холестерина в желчные кислоты (Kook et al. 2012).
Инсерционная мутация в 12 экзоне собачьей АТФ-связывающей кассеты (ABCB4), может быть фактом повышенного риска развития МЖП у шотландских овчарок (Cullen 2009; Mealey et al. 2010). Эта мутация элиминирует более 50% функциональных белков. Функция ABCB4 заключается в фосфолипидной транслокации в каналикулярной мембране гепатоцитов. При снижении этой функции, концентрация фосфолипидов в просвете желчных путей уменьшается, что увеличивает цитотоксичность желчных кислот (Mahaffey 2011; Mealey et al. 2010).
Другие стероидные гормоны (например, прогестерон) приводят к ингибированию сократимости желчного пузыря. Холестаз может приводить к развитию МЖП из-за концентрации желчи, которая стимулирует секрецию слизи.
Диагностика мукоцеле желчного пузыря у собак
Анамнез
Чаще всего мукоцеле диагностируют у собак мелких и средних пород. Средний возраст постановки диагноза ~ 9.1 год. Половая предрасположенность не выявлена. Шотландские овчарки предрасположены к патологиям желчного пузыря из-за дислипидемий и нарушения его сократимости. Другие часто встречаемые породы: кокер-спаниели и миниатюрные шнауцеры.
Клинические симптомы
Клинические симптомы обычно неспецифичные: рвота (69.3%), летаргия (44%), анорексия (42.2%), абдоминальная боль (19.3%), желтуха (16.3%) и полидипсия/полиурия (7.8%). Длительность симптомов ~ 5 суток до обращения в клинику (симптомы отмечаются в 71.3% случаев).
Лабораторные исследования
По общему анализу крови в 46.9% случаев отмечается лейкоцитоз и нейтрофилия со сдвигом влево.
По биохимическому анализу крови, выявляется повышение активности щелочной фосфатазы (ЩФ) в 98.2%, аланинаминотрансферазы (АЛТ) в 87.4%, гаммаглутаминтрансферазы (ГГТ) в 85.7% и аспартатаминотрасферазы (АСТ) в 62.2% случаев. Гипербилируминемия отмечается в 83.2% случаев. Повышение амилазы и липазы, встречается в 29.5% и 33.3% случаев, соответственно. Холестерин повышен в 55.6% случаев.
Однако, наиболее значимыми маркерами прогноза являются: повышение концентрации лактата и сниженный гематокрит (Malek et al. 2013).
Ультразвуковое исследование
Классической картиной, мукоцеле желчного пузыря у собак, считается звездчатый паттерн, который в отличие от сладжа, не смещается под действием силы тяжести (Besso et al. 2000).
Наиболее распространенные находки у собак с клинически значимым мукоцеле: утолщение стенки желчного пузыря, эхогенная свободная жидкость и повышенная эхогенность тканей в области желчной ямки. Ультразвуковыми находками разрыва желчного пузыря, обладающими 100% специфичностью, являются: нарушение целостности стенки органа, гиперэхогенность жировой ткани в краниальной части брюшной полости и наличие свободной перитонеальной жидкости.
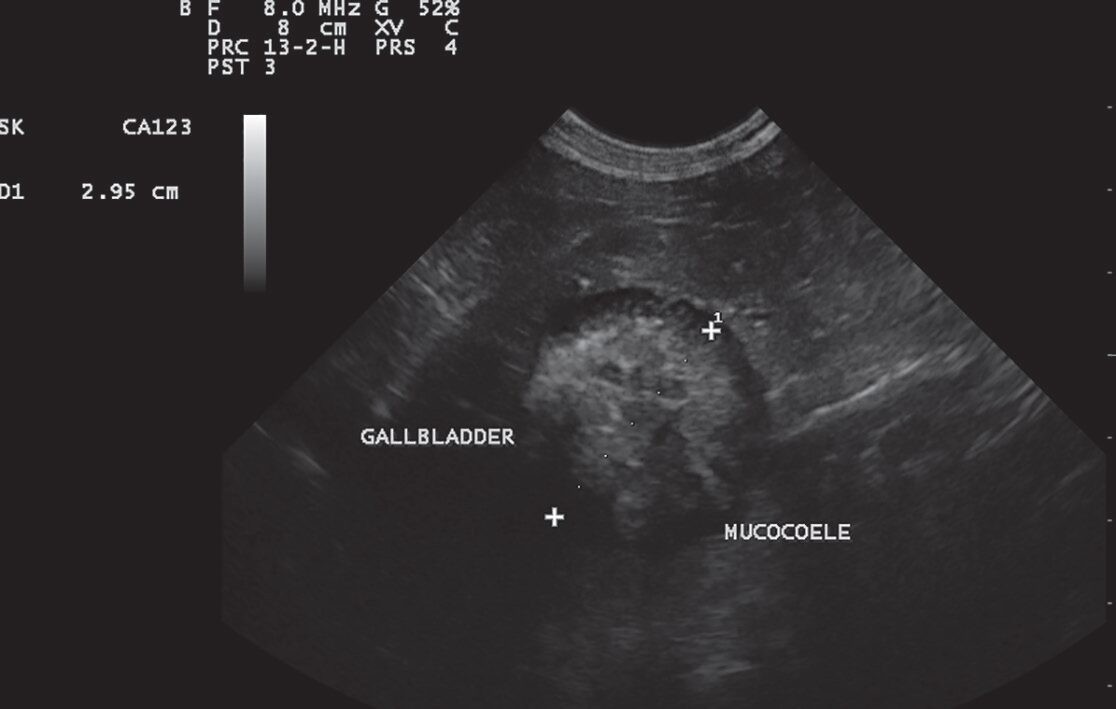
Рисунок 3. Сагиттальное изображение желчного пузыря у собаки с мукоцеле. Гиперэхогенное мукоцеле (2.95 см в диаметре) с анэхогенным кольцом. Стенка желчного пузыря без выраженного утолщения. Мукоцеле имеет не типичный «кивиобразный» или «звездчатый» вид.
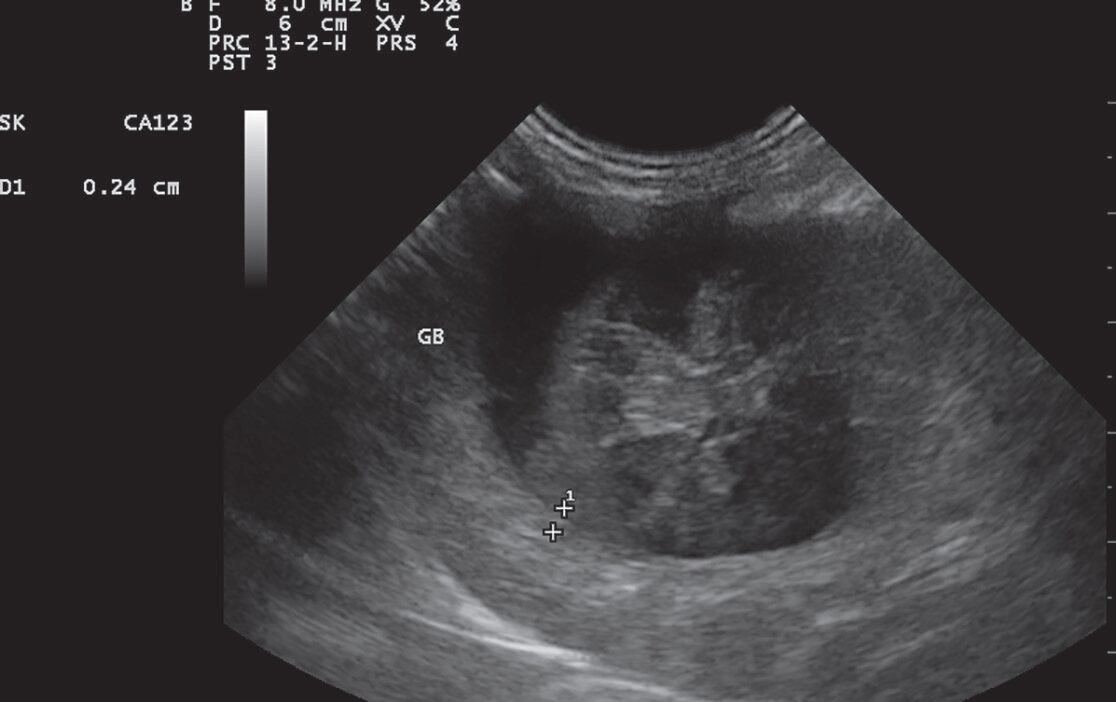
Рисунок 4. Сагиттальное изображение желчного пузыря у собаки с мукоцеле. На изображении представлен характерный «кивиподобный» вид мукоцеле. Вокруг мукоцеле есть гипоэхогенное кольцо и утолщение стенки желчного пузыря.
Бактериологическое исследование
Примерно в 13.5% случаев у собак с мукоцеле есть бактериальная колонизация желчного пузыря. Пункцию желчного пузыря стоит проводить с осторожностью из-за рисков развития желчного перитонита, брадикардии (стимуляция вагуса), бактериемии и кровотечения.
Патоморфология
Рекомендовано проводить гистологическое исследование удаленных желчных пузырей для постановки окончательного диагноза. При микроскопии обычно выявляют гиперплазию слизистого слоя. В ряде случаев находят ишемический некроз в области дна желчного пузыря, который предшествует разрыву.
Лечение мукоцеле у собак
Медикаментозная терапия
Медикаментозную терапию МЖП у собак допустимо проводить у животных без клинических признаков заболевания. В таких случаях важно выявить и устранить, способствующие развитию мукоцеле, эндокринные заболевания (гипотиреоидизм, гиперадренокортицизм).
Владельцы должны быть информированы о возможном резком ухудшении течения заболевания, требующем неотложного хирургического вмешательства по причине обструкции желчных протоков или разрыва желчного пузыря.
Терапия заключается в применении желчегонных и гепатопротективных средств. Урсодезоксихолевая кислота является природной желчной кислотой, которая оказывает желчегонное и гапатопротективное действие. Суточная доза составляет 10-15 мг/кг, которую можно давать один раз в сутки или разделить на два приема.
S-Аденозилметионин — натуральный прекурсор цистеина, который необходим для продукции антиоксиданта глутатиона. Суточная доза составляет 18-20 мг/кг, которую дают однократно на «голодный» желудок.
Низкожировая диета рекомендована, особенно у животных с нарушенным липидным обменом.
Регулярные осмотры необходимы каждые 2-4 недели (ультразвуковое исследование, анализы крови) для оценки состояния желчного пузыря и решение вопроса о дальнейшей консервативной терапии или хирургическом лечении.
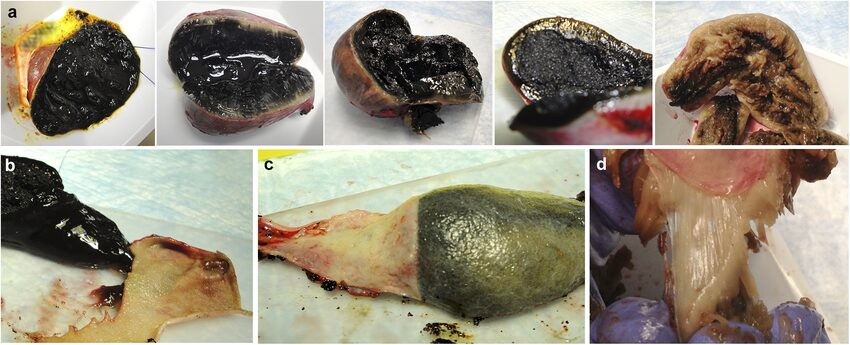
Рисунок 5. Различный характер сожержимого желчного пузыря у собак с мукоцеле.
Хирургическая операция
Хирургическая операция является золотым стандартом лечения мукоцеле у собак. Предоперационная подготовка, включает в себя ультразвуковое исследование, общий и биохимический анализы крови и коагулограмму.
Операция заключается в проведении холецистэктомии (удалении желчного пузыря). Обязательным условием является послеоперационное гистологическое (желчный пузырь и печень) и бактериологическое исследования. Критически важно перед удалением желчного пузыря, убедиться в проходимости желчных протоков. Не редко требуется их промывание с целью удаления густой желчи, холелитов и слизи для нормализации оттока желчи.
Лапароскопическое удаление мукоцеле допустимо проводить после исключения обструкции желчных протоков или разрыва желчного пузыря.
Холецистотомия с удалением содержимого не рекомендована из-за высоких рисков рецидива мукоцеле или несостоятельности швов. Холецистоэнтеростомия может потребоваться в редких случаях мукоцеле с необратимой обструкцией желчных протоков.
В послеоперационном периоде собакам назначают низкожировую диету, гепатопротекторы и противомикробные средства.
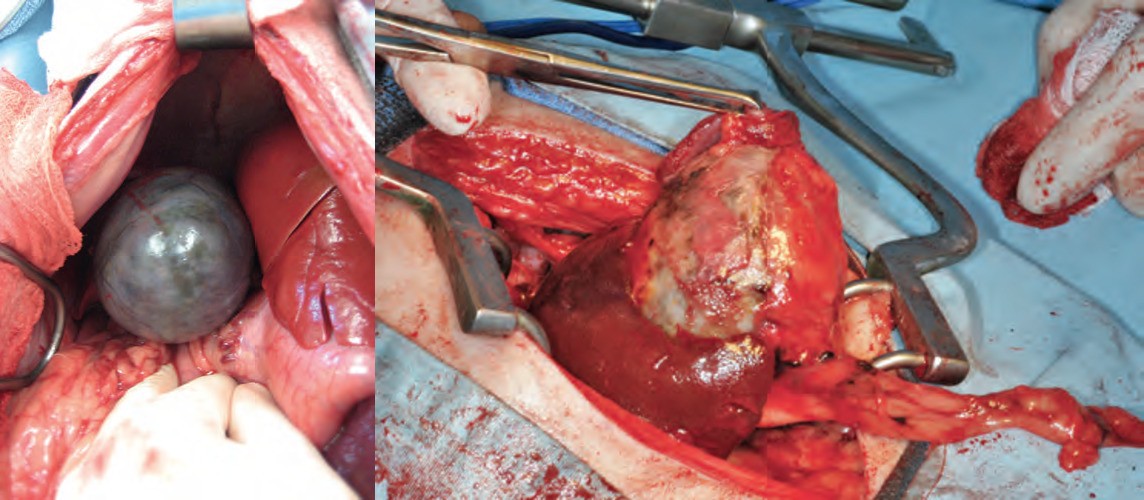
Рисунок 6 (слева на право): В данном случае желчный пузырь с мукоцеле у собаки без признаков перфорации или обструкции желчных протоков; Мукоцеле желчного пузыря у собаки со спайками с окружающими тканями и признаками некроза стенки.
Прогноз и выводы
Выживаемость после оперативного лечения желчной системы составляет 66%. Лучшие результаты отмечаются при проведении операции у клинически стабильных животных, без признаков обструкции желчных протоков, некроза или перфорации стенки желчного пузыря (летальность менее 5%). Наиболее плохие результаты отмечаются у собак, которым потребовалось проведение холецистоэнтеростомии.
К наиболее частым осложнениям относят: желчный перитонит, сепсис, ДВС-синдром и несостоятельность швов. Сопутствующий панкреатит ухудшает прогноз. Послеоперационное увеличение концентрации лактата и гипотензия, связаны с более худшими результатами лечения.
По данным этой статьи, стоит сделать несколько выводов:
- Застой желчи у собак с мукоцеле вызывает нарушение ее эвакуации из полости желчного пузыря и может привести к обструкции желчных ходов, некрозу или перфорации стенки желчного пузыря;
- Причина развития мукоцеле многофакторная и комплексная (эндокринные заболевания, нарушение липидного обмена, генетическая предрасположенность, инфекция);
- В неосложненных случаях допустимо консервативное лечение мукоцеле, успех которого во многом зависит от элиминации основной причины заболевания;
- Важно понимать, что животным с мукоцеле требуется тщательный мониторинг в процессе лечения, так как ухудшение течения заболевания может произойти за короткий промежуток времени, что будет требовать оказания срочной помощи;
- Удаление желчного пузыря является самым эффективным методом лечения мукоцеле, лучшие результаты и выживаемость отмечаются у собак без выраженных клинических признаков, обструкции желчных протоков и некроза или перфорации стенки желчного пузыря.
Список используемой литературы
Базовая статья
Научные публикации
Полные версии статьей можно найти на сайте — PubMed.
- Aguirre, A.L., Center, S.A., Randolph, J.F., Yeager, A.E., Keegan, A.M., Harvey, H.J. et al., 2007, ‘Gallbladder disease in Shetland sheepdogs: 38 cases (1995–2005)’, Journal of the American Veterinary Medical Association 231(1), 79–88. PMID: 17605668, http://dx.doi.org/10.2460/javma.231.1.79
- Amsellem, P.M., Seim III, H.B., MacPhail, C.M., Bright, R.M., Twedt, D.C., Wrigley, R.H. et al., 2006, ‘Long-term survival and risk factors associated with biliary surgery in dogs: 34 cases (1994–2004)’, Journal of the American Veterinary Medical Association 229(9), 1451–1457. PMID: 17078808, http://dx.doi.org/10.2460/javma.229.9.1451
- Bennett, S.L., Milne, M., Slocombe, R.F. & Landon, B.P., 2007, ‘Gallbladder mucocoele and concurrent hepatic lipidosis in a cat’, Australian Veterinary Journal 85(10), 397–400. PMID: 17903126, http://dx.doi.org/10.1111/j.1751-0813.2007.00182.x
- Besso, J.G., Wrigley, R.H., Gliatto, J.M. & Webster, C.R.L., 2000, ‘Ultrasonographic appearance and clinical findings in 14 dogs with gallbladder mucocele’, Veterinary Radiology and Ultrasound 41(3), 261 271. PMID: 10850878, http://dx.doi. org/10.1111/j.1740-8261.2000.tb01489.x
- Center, S.A., 2009, ‘Diseases of the gallbladder and biliary tree’, Veterinary Clinics of North America: Small Animal Practice 39(3), 543–598. PMID: 19524793, http://dx.doi.org/10.1016/j.cvsm.2009.01.004
- Choi, J., Kim, A., Keh, S., Oh, J., Kim, H. & Yoon, J., 2014, ‘Comparison between ultrasonographic and clinical findings in 43 dogs with gallbladder mucoceles’, Veterinary Radiology and Ultrasound 55(2), 202–207. PMID: 24219310, http://dx.doi.org/10.1111/vru.12120
- Crews, L.J., Feeney, D.A., Jessen, C.R., Rose, N.D. & Matise, I., 2009, ‘Clinical, ultrasonographic, and laboratory findings associated with gallbladder disease and rupture in dogs: 45 cases (1997–2007)’, Journal of the American Veterinary Medical Association 234(3), 359–366. PMID: 19210257, http://dx.doi.org/10.2460/javma.234.3.359
- Cullen, J.M., 2009, ‘Summary of the World Small Animal Veterinary Association Standardization Committee guide to classification of liver disease in dogs and cats’, Veterinary Clinics of North America: Small Animal Practice 39(3), 395–418. PMID: 19524786, http://dx.doi.org/10.1016/j.cvsm.2009.02.003
- Escobar, M.C. & Neel, J.A., 2011, ‘Pathology in practice’, Journal of the American Veterinary Medical Association 239(1), 65–67. PMID: 21718197, http://dx.doi.org/10.2460/javma.239.1.65
- Gaschen, L., 2009, ‘Update on hepatobiliary imaging’, Veterinary Clinics of North America: Small Animal Practice 39(3), 439–467. PMID: 19524788, http://dx.doi.org/10.1016/j.cvsm.2009.02.005
- Head, L.L. & Daniel, G.B., 2005, ‘Correlation between hepatobiliary scintigraphy and surgery or postmortem examination findings in dogs and cats with extrahepatic biliary obstruction, partial obstruction, or patency of the biliary system: 18 cases (1995–2004)’, Journal of the American Veterinary Medical Association 227(10), 1618–1624. PMID: 16313040, http://dx.doi.org/10.2460/javma.2005.227.1618
- Klinkspoor, J.H., Kuver, R., Savard, C.E., Oda, D., Azzouz, H., Tytgat, G.N. et al., 1995, ‘Model bile and bile salts accelerate mucin secretion by cultured dog gallbladder epithelial cells’, Gastroenterology 109(1), 264 274. PMID: 7797024.
- Kook, P.H., Schellenberg, S., Rentsch, K.M., Reusch, C.E. & Glaus, T.M., 2011, ‘Effect of twice-daily oral administration of hydrocortisone on the bile acids composition of gallbladder bile in dogs’, American Journal of Veterinary Research 72(12), 1607–1612. PMID: 22126688, http://dx.doi.org/10.2460/ajvr.72.12.1607
- Kook, P.H., Schellenberg, S., Rentsch, K.M., Reusch, C.E. & Glaus, T.M., 2012, ‘Effects of iatrogenic hypercortisolism on gallbladder sludge formation and biochemical bile constituents in dogs’, Veterinary Journal 191(2), 225–230. PMID: 21316991, http://dx.doi.org/10.1016/j.tvjl.2011.01.004
- Laukkarinen, J., Sand, J., Aittomäki, S., Pörsti, I., Kööbi, P., Kalliovalkama, J. et al., 2002, ‘Mechanism of the prorelaxing effect of thyroxine on the sphincter of Oddi’, Scandinavian Journal of Gastroenterology 37(6), 667 673. PMID: 12126244.
- Mahaffey, M.B., 2011, ‘Gallbladder mucoceles in Shetland sheepdogs’, viewed 18 October 2013, from http://www.8865966.comassa.org/documents/Gallbladderarticlewebmarch2011.pdf
- Malek, S., Sinclair, E., Hosgood, G., Moens, N.M.M., Baily, T. & Boston, S.E., 2013, ‘Clinical findings and prognostic factors for dogs undergoing cholecystectomy for gall bladder mucocele’, Veterinary Surgery 42(4), 418 426. PMID: 23330871, http://dx.doi.org/10.1111/j.1532 950X.2012.01072.x
- Mayhew, P.D., Mehler, S.J. & Radhakrishnan, A., 2008, ‘Laparoscopic cholecystectomy for management of uncomplicated gall bladder mucocele in six dogs’, Veterinary Surgery 37(7), 625–630. PMID: 19134084, http://dx.doi.org/10.1111/j.1532-950X.2008.00428.x
- Mealey, K.L., Minch, J.D., White, S.N., Snekvik, K.R. & Mattoon, J.S., 2010, ‘An insertion mutation in ABCB4 is associated with gallbladder mucocele formation in dogs’, Comparative Hepatology 9(1), 6. PMID: 20598156, http://dx.doi. org/10.1186/1476-5926-9-6
- Meler, E. & Pressler, B., 2010, ‘Research updates: Dogs with gallbladder mucoceles may be prone to common endocrine diseases’ dvm360.com, viewed 18 October 2013, from http://veterinarymedicine.dvm360.com/vetmed/ArticleStandard/ Article/detail/679012
- Mesich, M.L.L., Mayhew, P.D., Paek, M., Holt, D.E. & Brown, D.C., 2009, ‘Gall bladder mucoceles and their association with endocrinopathies in dogs: A retrospective case‐control study’, Journal of Small Animal Practice 50(12), 630–635. PMID: 19954439, http://dx.doi.org/10.1111/j.1748 5827.2009.00811.x
- Mitchell, K.D., 2010, ‘Pharmacological management of canine and feline liver disease (Proceedings)’, dvm360.com, viewed 18 October 2013, from http://veterinarycalendar.dvm360.com/avhc/Medicine/Pharmacological-managementof-canine-and-felineli/ArticleStandard/Article/detail/738523 Norwich, A., 2011, ‘Gallbladder mucocele in a 12-year-old cocker spaniel’, Canadian Veterinary Journal 52(3), 319–321. PMID: 21629430.
- Pike, F.S., Berg, J., King, N.W., Penninck, D.G. & Webster, C.R., 2004, ‘Gallbladder mucocele in dogs: 30 cases (2000–2002)’, Journal of the American Veterinary Medical Association 224(10), 1615–1622. PMID: 15154731, http://dx.doi.org/10.2460/javma.2004.224.1615
- Quinn, R. & Cook, A.K., 2009, ‘An update on gallbladder mucoceles in dogs’, dvm360.com, viewed 18 October 2013, from http://veterinarymedicine.dvm360.com/vetmed/ArticleStandard/Article/detail/591378
- Reed, W.H. & Ramirez, S., American College of Veterinary Radiology, 2007, ‘What is your diagnosis?’, Journal of the American Veterinary Medical Association 230(5), 661–662. PMID: 17331046.
- Tsukagoshi, T., Ohno, K., Tsukamoto, A., Fukushima, K., Takahashi, M., Nakashima, K. et al., 2012, ‘Decreased gallbladder emptying in dogs with biliary sludge or gallbladder mucocele’, Veterinary Radiology and Ultrasound 53(1), 84–91. PMID: 22093059, http://dx.doi.org/10.1111/j.1740-8261.2011.01868.x
- Uno, T., Okamoto, K., Onaka, T., Fujita, K., Yamamura, H. & Sakai, T., 2009, ‘Correlation between ultrasonographic imaging of the gallbladder and gallbladder content in eleven cholecystectomised dogs and their prognoses’, Journal of Veterinary Medical Science 71(10), 1295–1300. PMID: 19887734, http://dx.doi.org/10.1292/jvms.001295
- Walter, R., Dunn, M.E., d’Anjou, M. & Lécuyer, M., 2008, ‘Nonsurgical resolution of gallbladder mucocele in two dogs’, Journal of the American Veterinary Medical Association 232(11), 1688–1693. PMID: 18518811, http://dx.doi.org/10.2460/javma.232.11.1688
- Woods, K.S., Brisson, B.A., Defarges, A.M. & Oblak, M.L., 2012, ‘Congenital duplex gallbladder and biliary mucocele associated with partial hepatic cholestasis and cholelithiasis in a cat’, Canadian Veterinary Journal 53(3), 269–273. PMID:22942442.
- Worley, D.R., Hottinger, H.A. & Lawrence, H.J., 2004, ‘Surgical management of gallbladder mucoceles in dogs: 22 cases (1999–2003)’, Journal of the American Veterinary Medical Association 225(9), 1418 1422. PMID: 15552319, http://dx.doi.org/10.2460/javma.2004.225.1418