Саркома (от латинского sarcoma — «мясо» или «плоть» + oma — «опухоль») — это группа злокачественных новообразований, развивающихся из соединительной (мезенхимальной) ткани (мышечная, жировая, синовиальная, костная, хрящевая, фиброзная и другие).
Сокращения: СМТ — саркома мягких тканей; ПСК — постинъекционных саркома кошек; ТИАБ — тонкоигольная аспирационная биопсия; УЗИ — ультразвуковое исследование; МРТ — магнитно-резонансная томография; КТ — компьютерная томография.
Соединительная ткань присутствует в любом органе животного или человека, следовательно саркомы могут встречаться в любой части тела живого организма.
Под термином саркома мягких тканей подразумевают группу подкожных новообразований со схожим биологическим поведением. Традиционно к данной группе относят: фибросаркому, гемангиоперицитому, липосаркому, злокачественную фиброзную гитсиоцитому, микосаркому, опухоли из оболочек переферических нервов, рабдомиосаркому, лимфангиосаркому, лейомиосаркому (последние три опухоли не всегда относят к СМТ).
Под термином постинъекционная саркома кошек (устаревшее название поствакцинальная саркома) подразумевают разновидность СМТ, которая развивается в местах инъекций лекарственных препаратов (область холки или паховой складки) и характеризуется крайне агрессивным биологическим поведением и высокой частотой рецидивирования.
Более подробно о различных мягкотканных саркомах (СМТ) у собак и кошек можно прочитать в ЭТОЙ статье.
В данной публикации речь пойдет о постинъекционных саркомах кошек, которые часто встречаются в практике ветеринарного врача, а подход к их диагностике и лечению отличается от общепринятого при традиционных формах СМТ.
Постинъекционные саркомы кошек
Постинъекционные саркомы кошек — это разновидность мягкотканных сарком, которые характеризуются агрессивным биологическим поведением и локализуются в местах введения вакцин и других лекарственных средств (K. N. Woodward, 2011).
Первые публикации о данной развитости СМТ у кошек начинаются с 1991 года (M. J. Hendrick and M. H. Goldschmidt, 1991), авторы которых ассоциируют развитие опухолей с инъекциями вакцин против бешенства содержащих в качестве адъюванта алюминий (M. J. Hendrick, et al., 1992.), это привело к появлению термина «поствакцинальная саркома кошек».
По данным различных исследований, шансы появления постинъекционной саркомы у кошки, составляют 1 случай на каждые 1000-10000 вакцинаций (J. Ladlow, 2013).
Однако в дальнейших исследованиях было установлено, что введение любых местнораздражающих веществ, провоцирующих хроническую воспалительную реакцию, может стать причиной злокачественной опухолевой трансформации клеток, а термин для обозначения данных новообразований изменили на «постинъекционная саркома кошек» (M. Martano, et al., 2011).
На данный момент, не смотря на активную пропаганду знаний и профилактическую борьбу с развитием постинъекционных сарком, количество обращений владельцев, с жалобами на наличие образования в области холки или паховой складки у их животных, остается на высоком уровне.
Этиология и патогенез (причины возникновения)
Считается, что злокачественная трансформация фибробластов и миофибробластов (клеток из которых состоит опухоль) у кошек индуцируются вторично — на фоне хронической воспалительной реакции из-за инъекций различных медикаментов.
Сроки возникновения опухоли могут составлять от 4 месяцев до 3 лет после введения инъекции.
Предрасполагающими факторами являются: многократная вакцинация, введение длительно действующих антибиотиков и глюкокортикостероидов, а также другим местнораздражающих веществ (A. Srivastav, et al., 2012; G. M. Gobar and P. H. Kass, 2002).
Есть единичные публикации о возникновении сарком после введения мелоксикама, а также из-за наличия микрочипа, гемостатической губки, нерассасывающегося шовного материала и подкожного порта для введения лекарств (Carminato A et al. 2011; Buracco et al. 2002; Esplin DG et al. 1999; Munday JS et al. 2011; McLeland SM et al. 2013; Haddad JL et al. 2010).
Примерно в половине случаев гистологическим типом постинъекционной (поствакцинальной) саркомы является фибросаркома. Другие возможные гистологические типы: злокачественная фиброзная гистиоцитома, внескелетная остеосаркома, рабдомиосаркома, хондросаркома и недифференцированная саркома (Hendrick ML et al. 1994).
Гистологически поствакцинальные саркомы характеризуются присутствием многоядерных гигантских клеток с лимфофолликулярным воспалением и наличием макрофагов, которые содержат в своих гранулах адъювант (Couto SS et al. 2002). По сравнению с обычными саркомами мягких тканей, вакциноассоциированные саркомы располагаются в гиподермальном слое кожи, содержат плохо дифференцированные клетки, частые фигуры митоза, очаги некроза и перитуморальное лимфоцитарное воспаление (Doddy FD et al. 1996).
Примерно в 28-51% случаев постинъекционные саркомы являются гистологически низкодифференцированными опухолями (высоко злокачественными) (Eckstein C et al. 2009).
Для поствакцинальных сарком характерен агрессивный рост с выраженной инфильтрацией окружающих здоровых тканей. Опухолевые клетки могут располагаться между мышечными и подкожными слоями далеко за пределы видимой опухоли.
Отдаленные метастазы, обычно в легкие, могут встречаться примерно в 25% случаев, особенно у животных с низкодифференцированными опухолями (С. Saba 2017).
Диагностика (постановка диагноза)
Диагностика ПСК редко является проблемой для ветеринарного врача из-за характерной клинической картины (C. Saba, 2017):
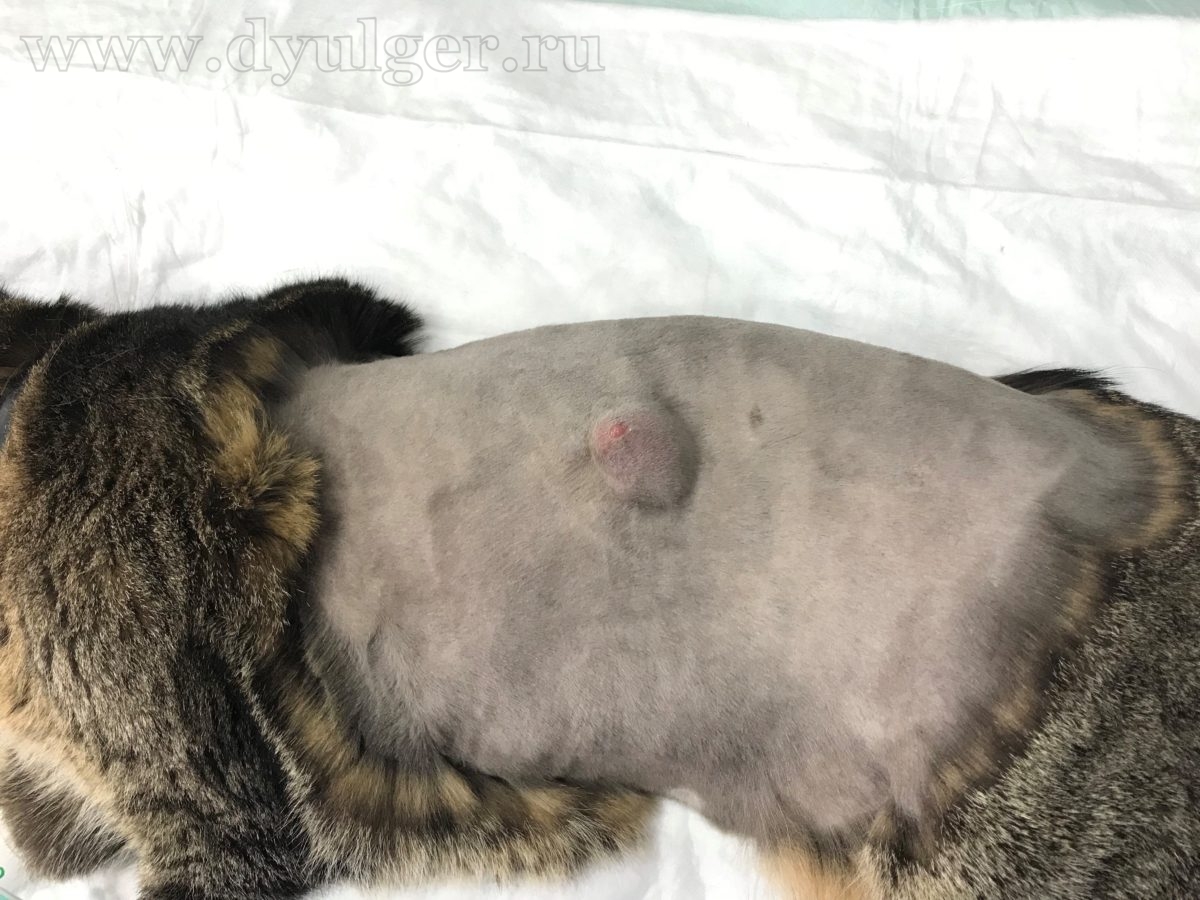
- Безболезненное и малоподвижное подкожное новообразование;
- Месторасположение: холка, лопатка и область паховой складки;
- Возраст животного 6-11 лет;
- Время появление: несколько недель или месяцев.
В некоторых случаях из-за кистозного строения опухоли, владельцы могут перепутать с кистой, серомой или абсцессом. Фотографии кошек с постинъекционными саркомами представлены ниже.
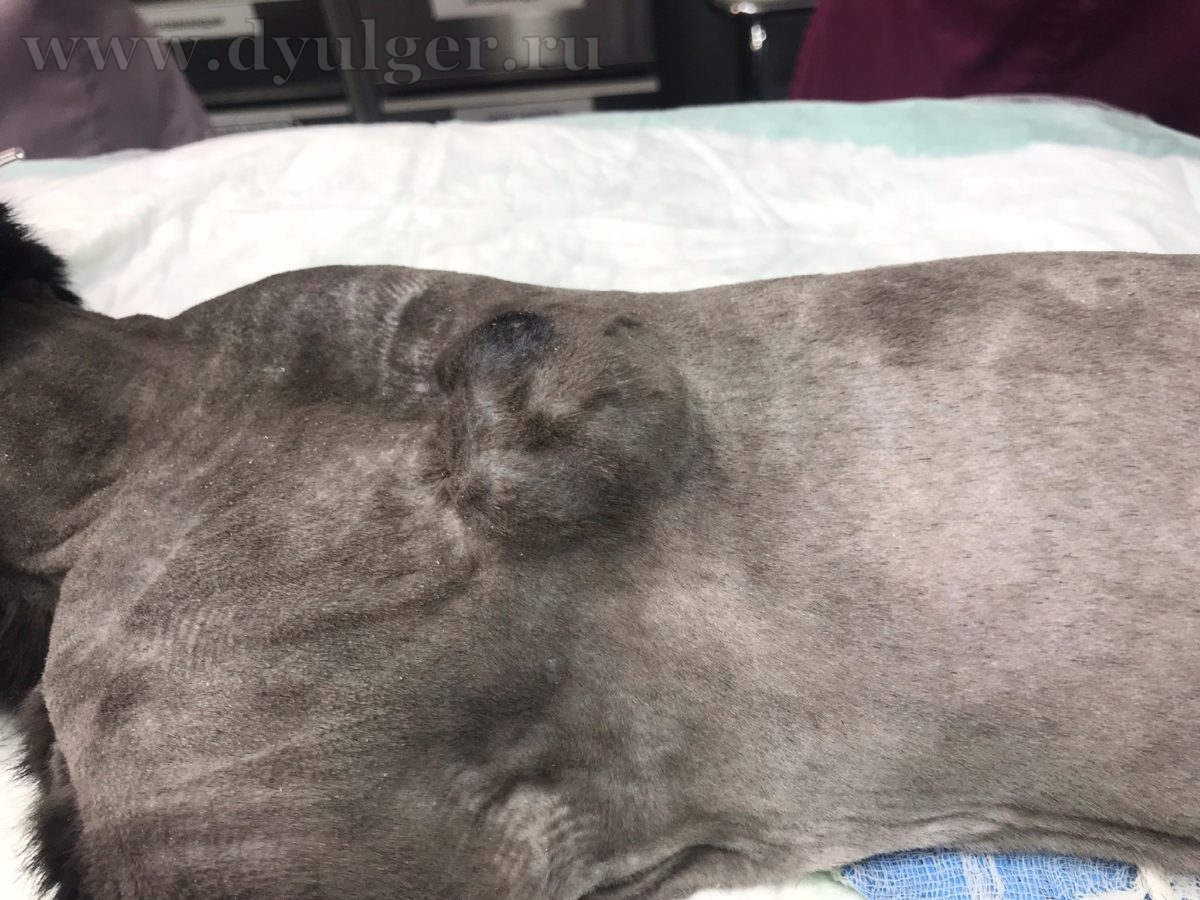
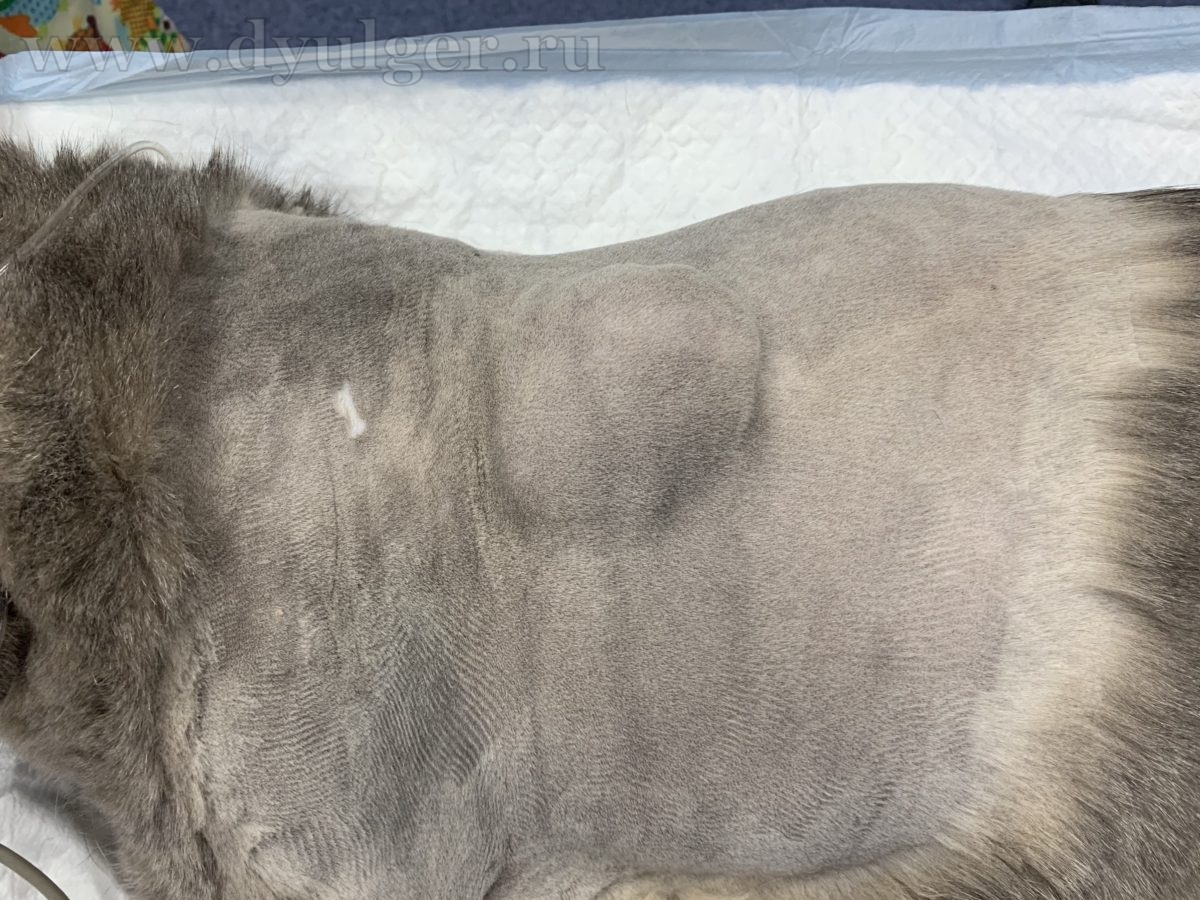
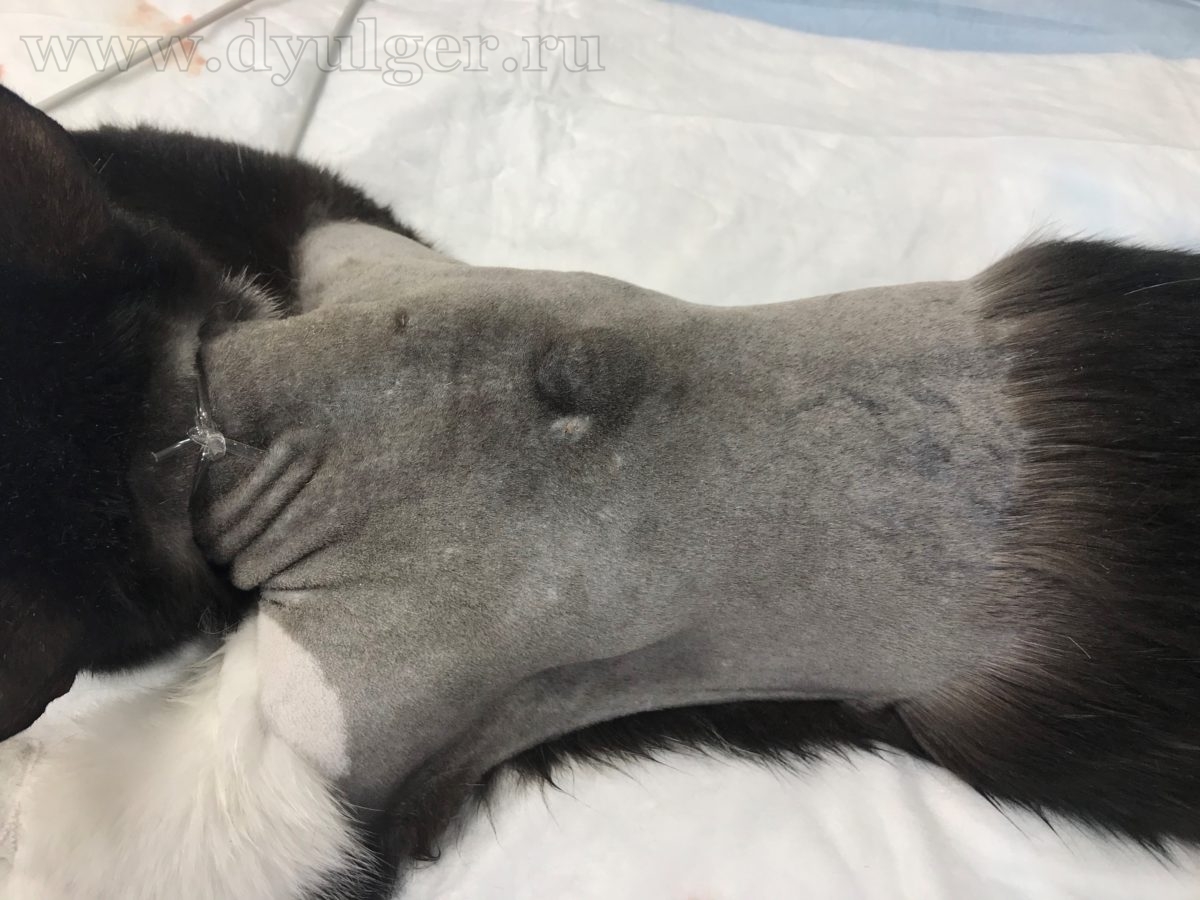
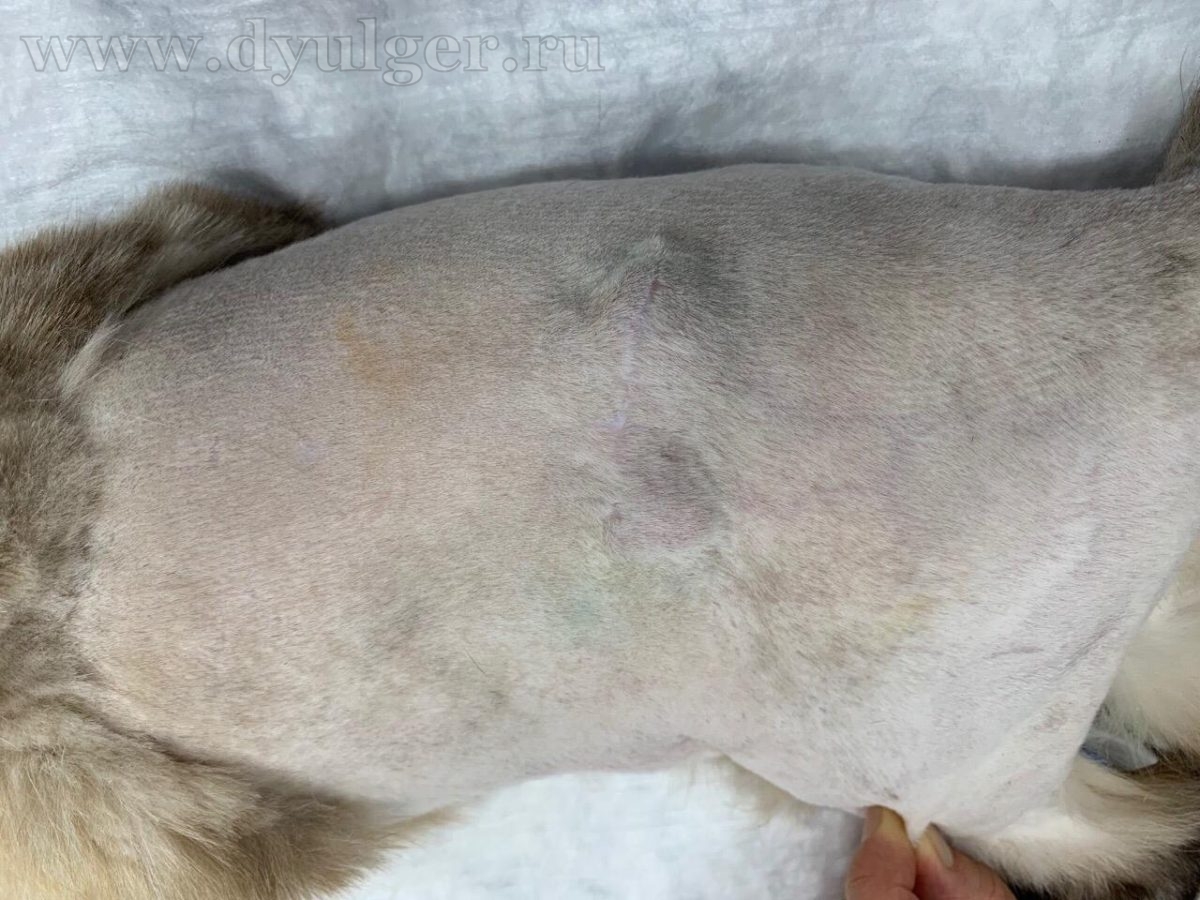
Для постановки патоморфологического диагноза необходимо провести тонкоигольную аспирационную (ТИАБ) или инцизионную биопсию. При выборе метода диагностики стоит отдавать предпочтение инцизионной биопсии, потому что ТИАБ позволяет поставить диагноз только примерно в 50% случаев (M. Martano, et al., 2011), а чувствительность гистологического исследования достигает 80-90% и позволяет определить степень дифференцировки опухоли, которая сильно влияет на прогноз заболевания.
Для определения стадии заболевания (исключение отдаленных метастазов) и исключения сопутствующих патологий проводят:
- Клинический и биохимический анализы крови;
- Рентгенографию органов грудной клетки;
- УЗИ органов брюшной полости;
Для оценки локального распространения заболевания и возможности его хирургического удаления проводят клинический осмотр и визуальные методы исследования (МРТ, КТ) (фото 5).
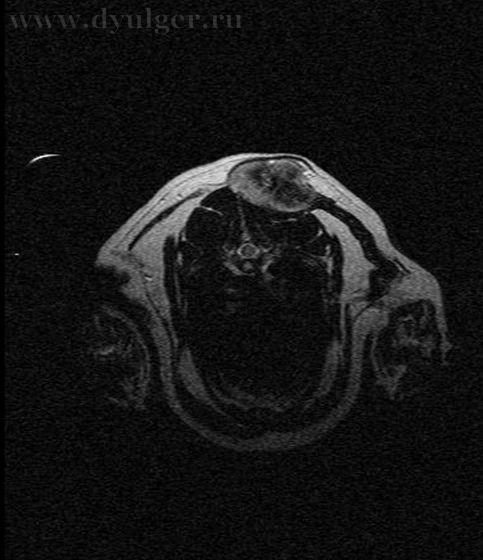
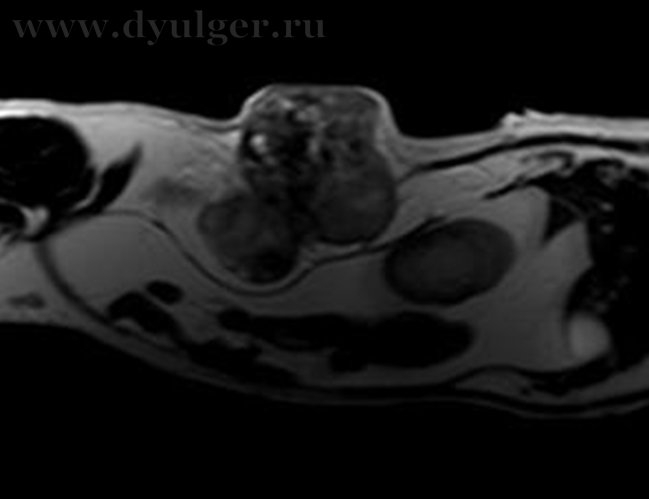
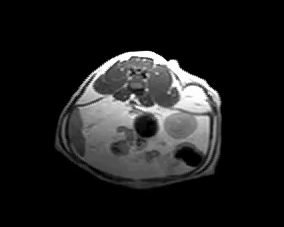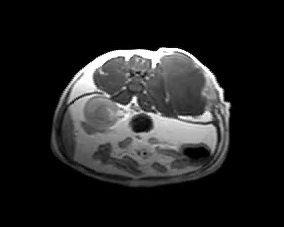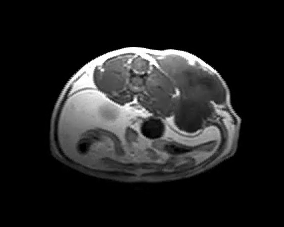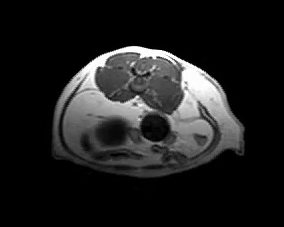
Фото 5. Различные примеры МРТ кошек с постинъекционными саркомами. Исследование позволяет понять степень локального распространения опухоли и оценить возможность радикальной резекции новообразования.
Лечение постинъекционных сарком кошек
Основным способом лечения постинъекционных сарком является хирургическое удаление опухоли.
Однако при пограничной резекции рецидивы наблюдаются примерно в 70% случаев (A. E. Hershey, et al., 2000). В связи с высокой частотой рецидивирования опухоли при местной эксцизии новообразования, на данный момент минимальный границей для резекции, является отступ в 2-3 сантиметра от видимых границ опухоли и захват 1 мышечной фасции в глубину, что позволяет снизить частоту рецидивирования до 36% (G. Romanelli, et al., 2008).
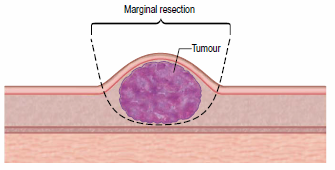
При пограничной (маргинальной) резекции СМТ у кошек, рецидивы отмечаются в большинстве случаев и достигают 70%!
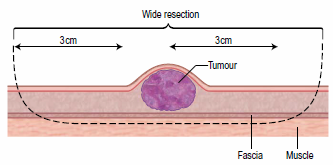
Схематическое изображение широкой резекции новообразования.
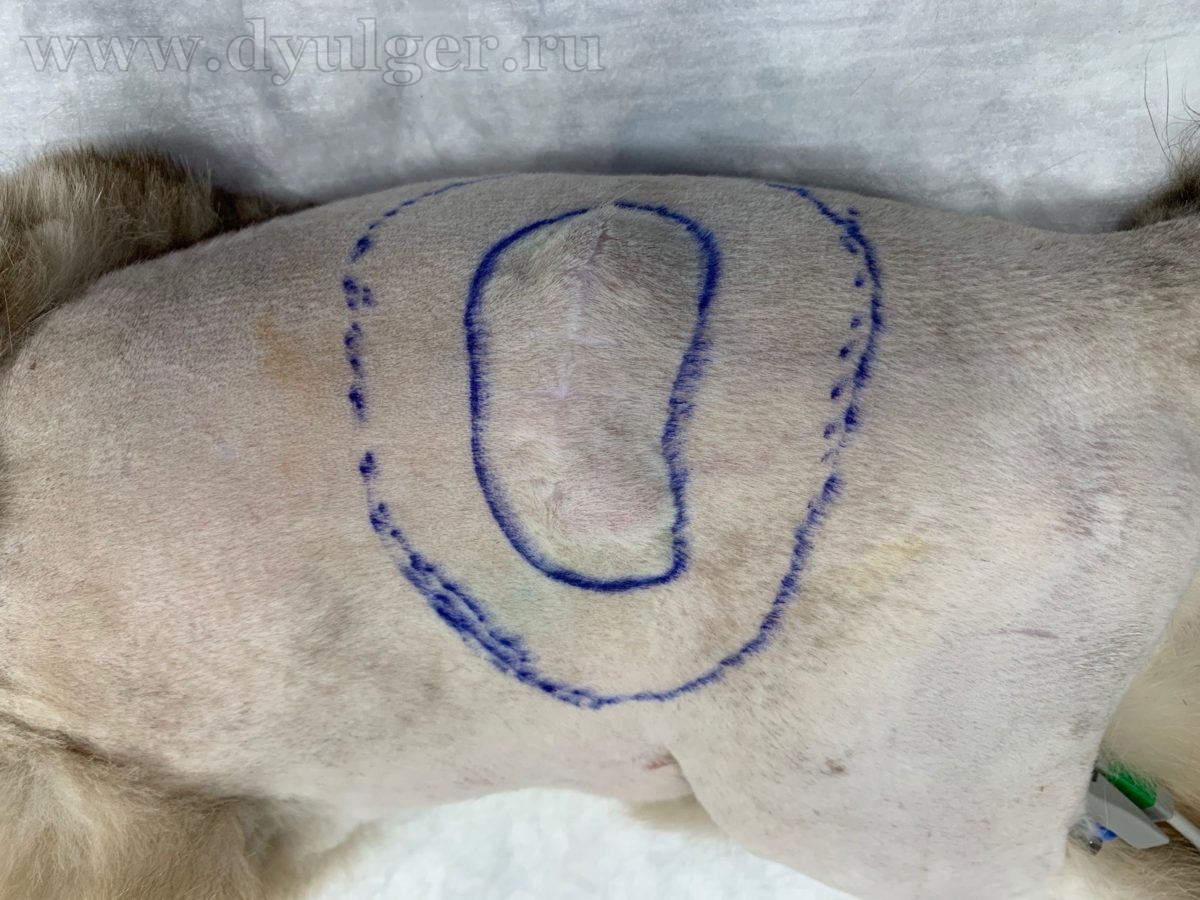
Более радикальным способом удаления постинъекционной саркомы у кошек является латеральный отступ в 5 сантиметров от границ новообразования и захватом 1-2 фасции в глубину, данная операция позволяет снизить шансы на рецидивирование до 14% (H. A. Phelps, et al., 2011) (фото 7).
В зависимости от места расположения опухоли, для достижения «чистых» границ резекции может потребоваться удалить большой объем подкожной и мышечной ткани, иногда требуется резекция вовлеченных в процесс костей (остистых отростков, дорсальной части лопатки и других), а для закрытия послеоперационной раны различные способы кожной пластики (фото 7).
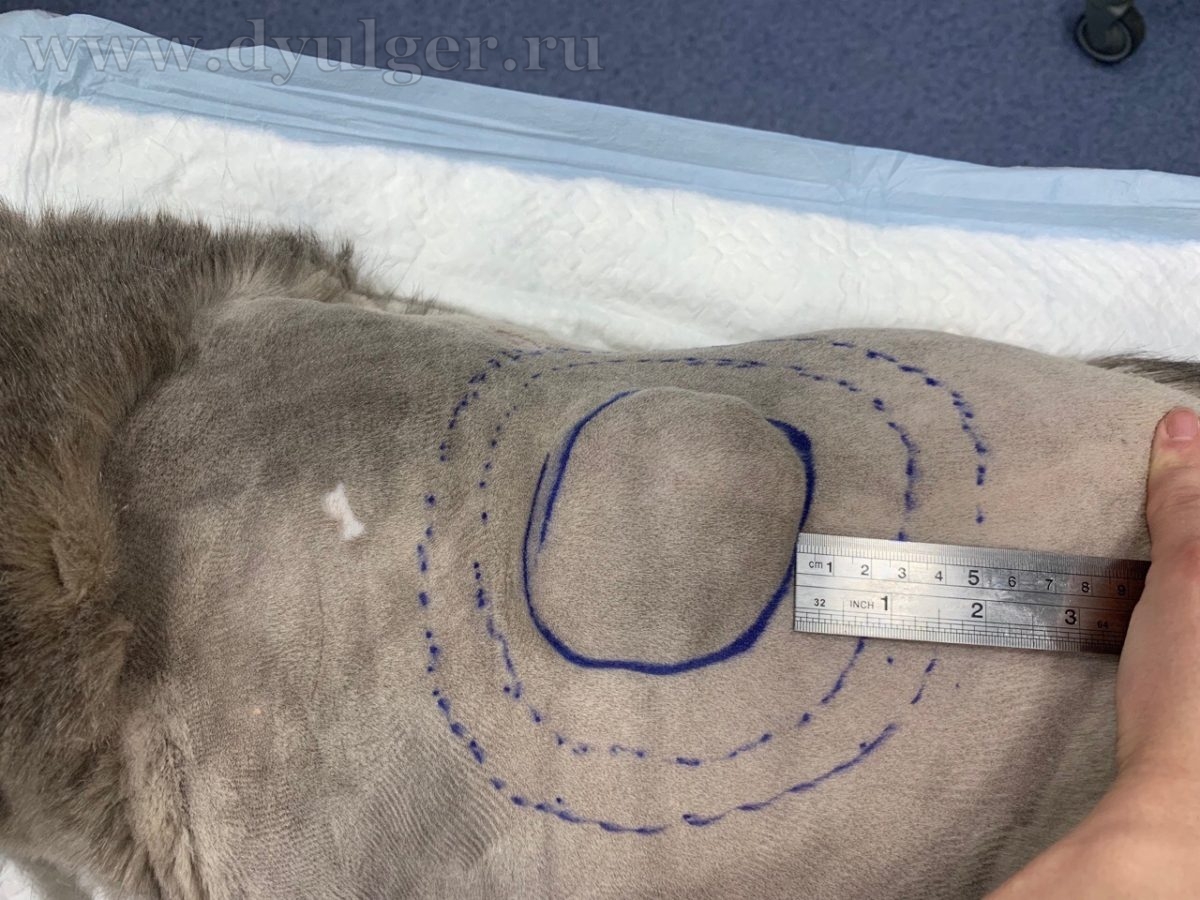
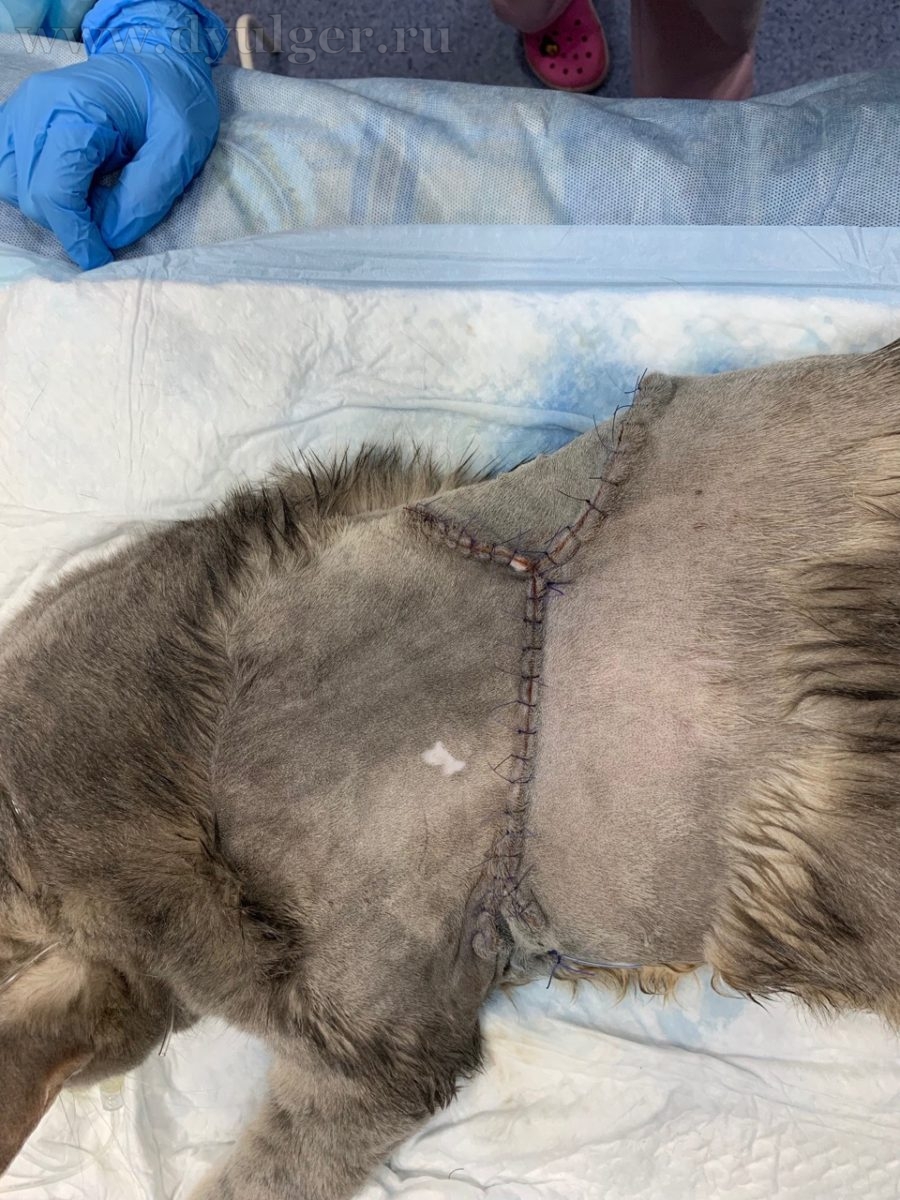
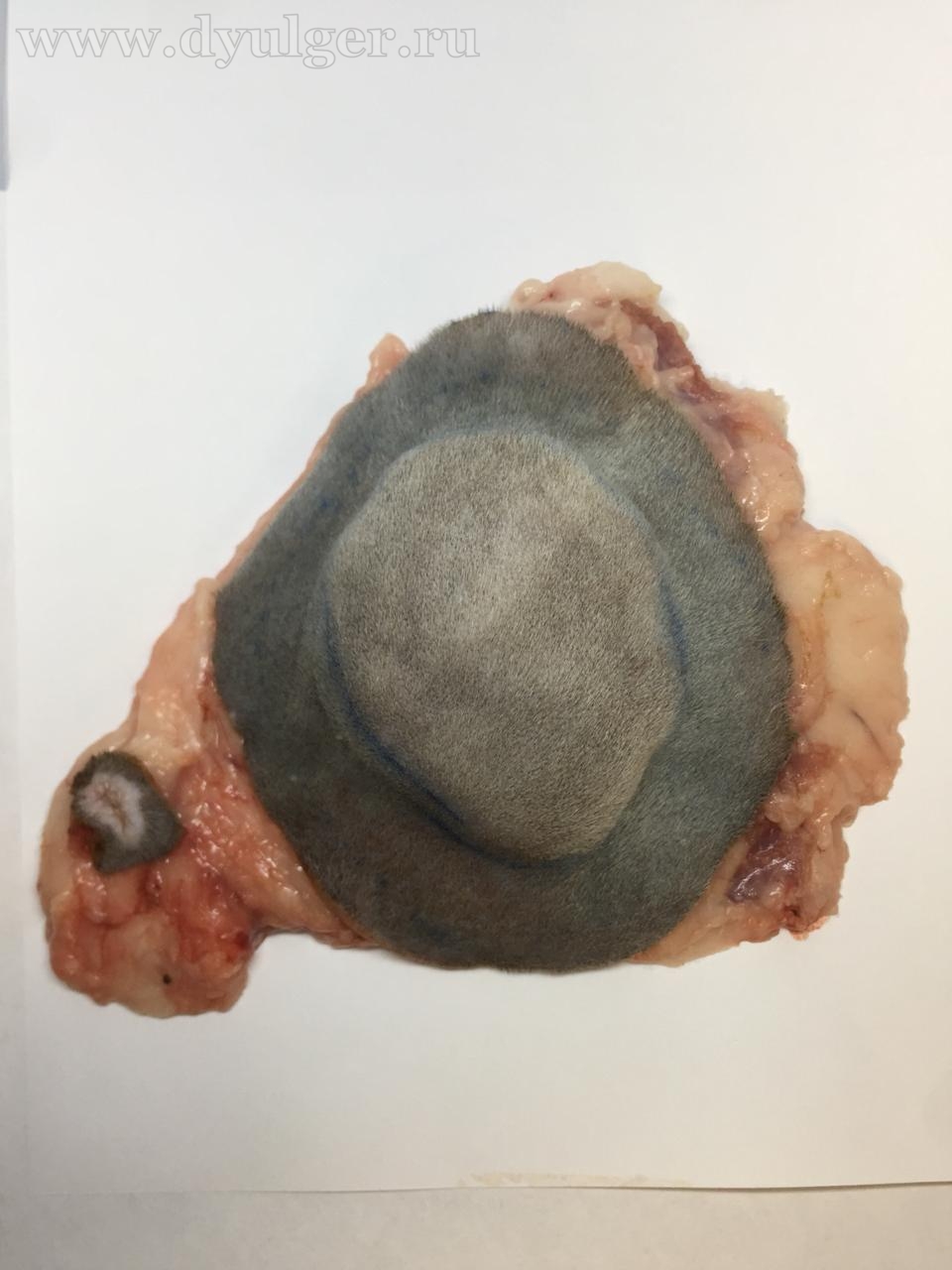
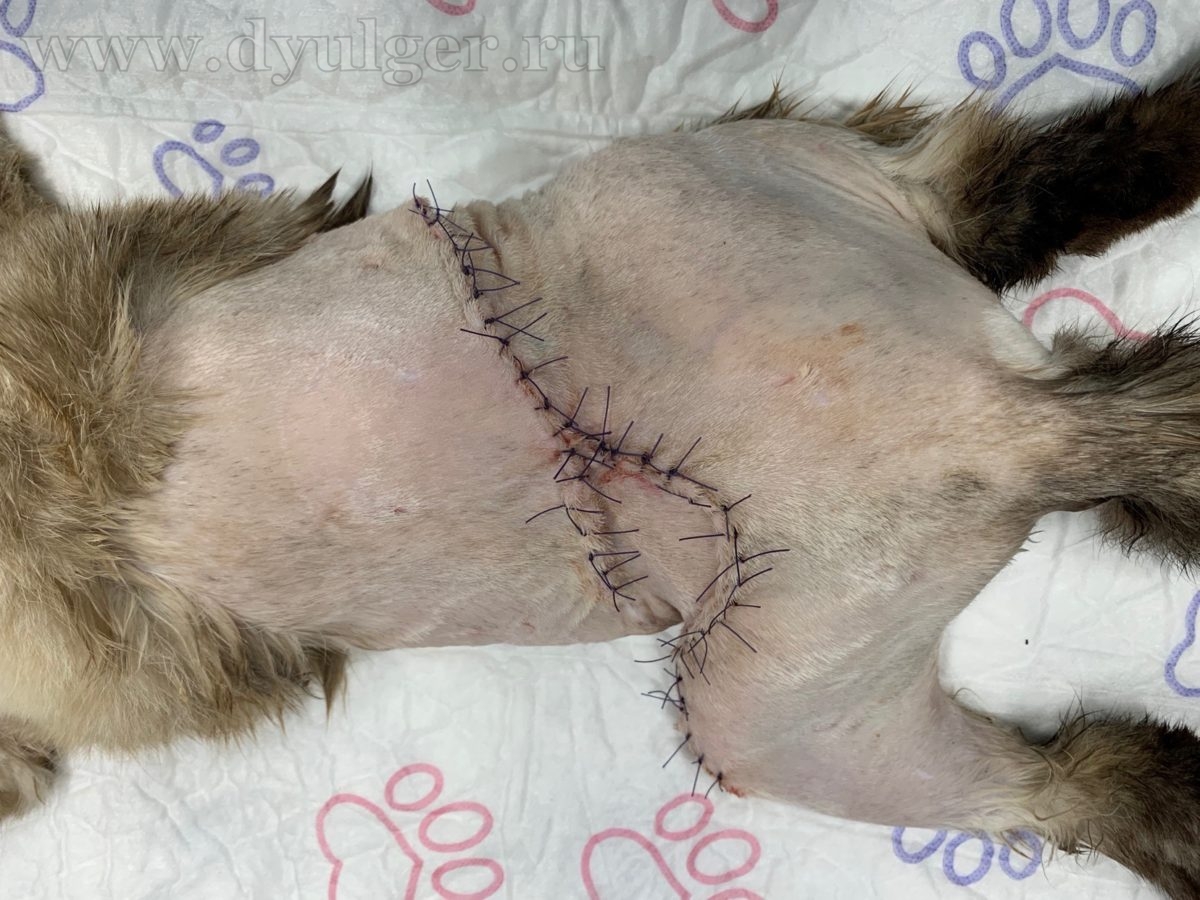
Фото 7. Клинический пример удаление постинъекционной саркомы с отступом 5 сантиметров и захватом 2 фасций в глубину. На картинке посередине показан послеоперационный шов. На изображении справа удаленная опухоль, которую отправляют в лаборатория для оценки границ резекции.
Для дополнительного снижения частоты рецидивирования и в случаях, когда радикальная резекция опухоли невозможна, дополнительно рекомендовано использовать лучевую терапию, которая в сочетании с хирургической операцией позволяет увеличить безрецидивный период и продолжительность жизни животного. Общая доза облучения обычно состаляет от 48 до 63 Грей, которую разделяют на 16-21 фракцию по 3-4 Гр. Облучение также можно рекомендовать кошкам с не полностью удаленными опухолями или так называемыми » грязными краями» резекции (C. Saba., 2017).
Химиотерапию рекомендовано проводить животным с низкодифференцированными саркомами для снижения риска метастазирования (метастазы могут встречаться в 10-28% случаев) или в ряде случаев с неоперабельными опухолями. Описаны различные протоколы химиотерапии с использованием доксорубицина, циклофосфамида, карбоплатина и ломустина. Также есть данные об использовании химиотерапии в метрономном режиме для снижения частоты рецидивирования (J. Ladlow, 2013).
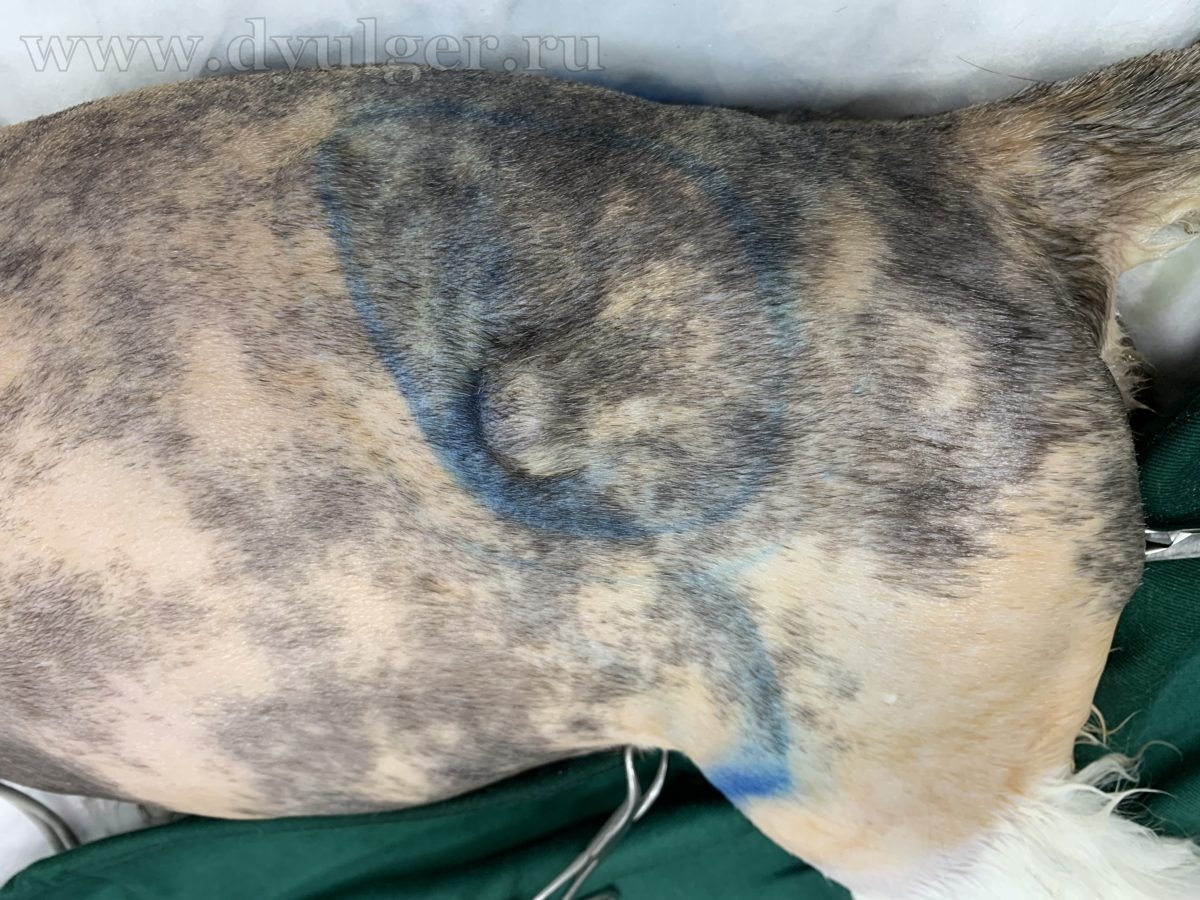
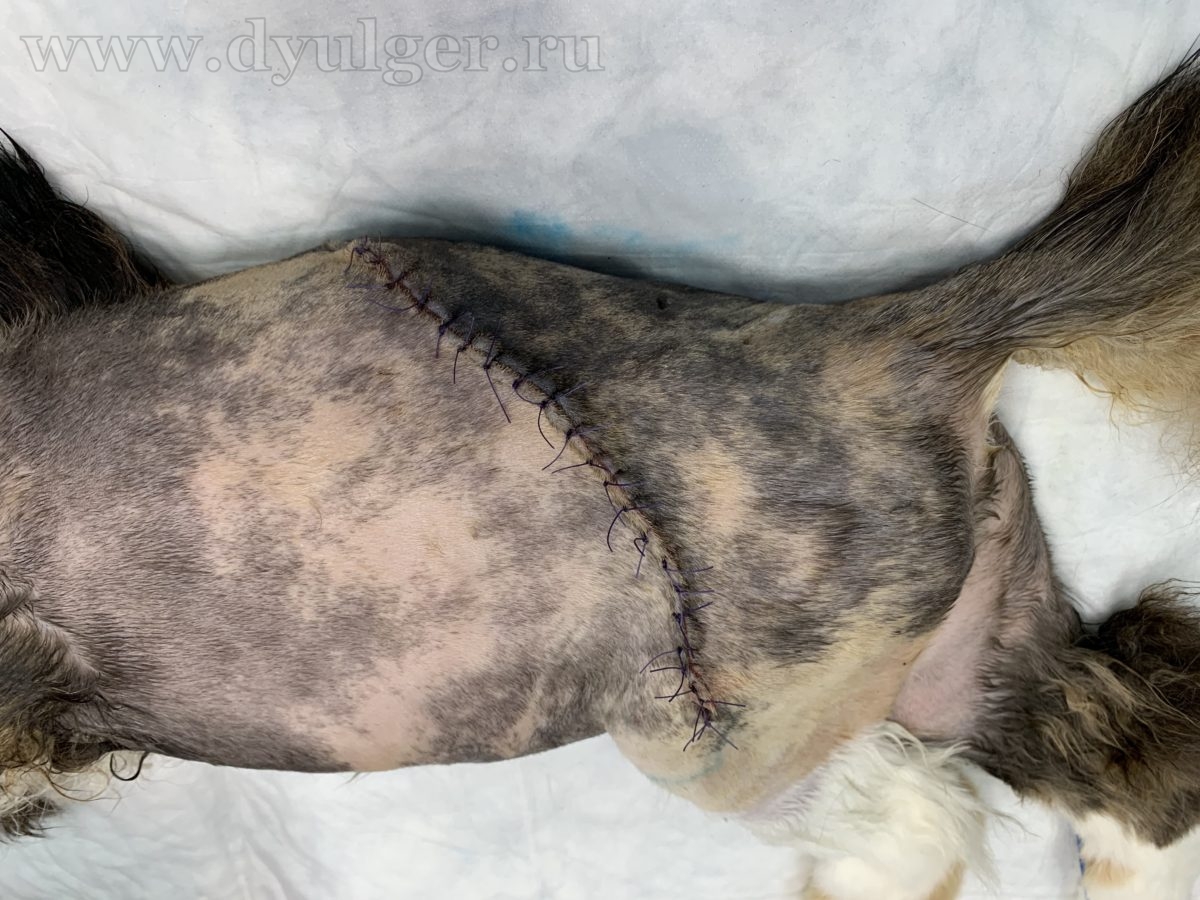
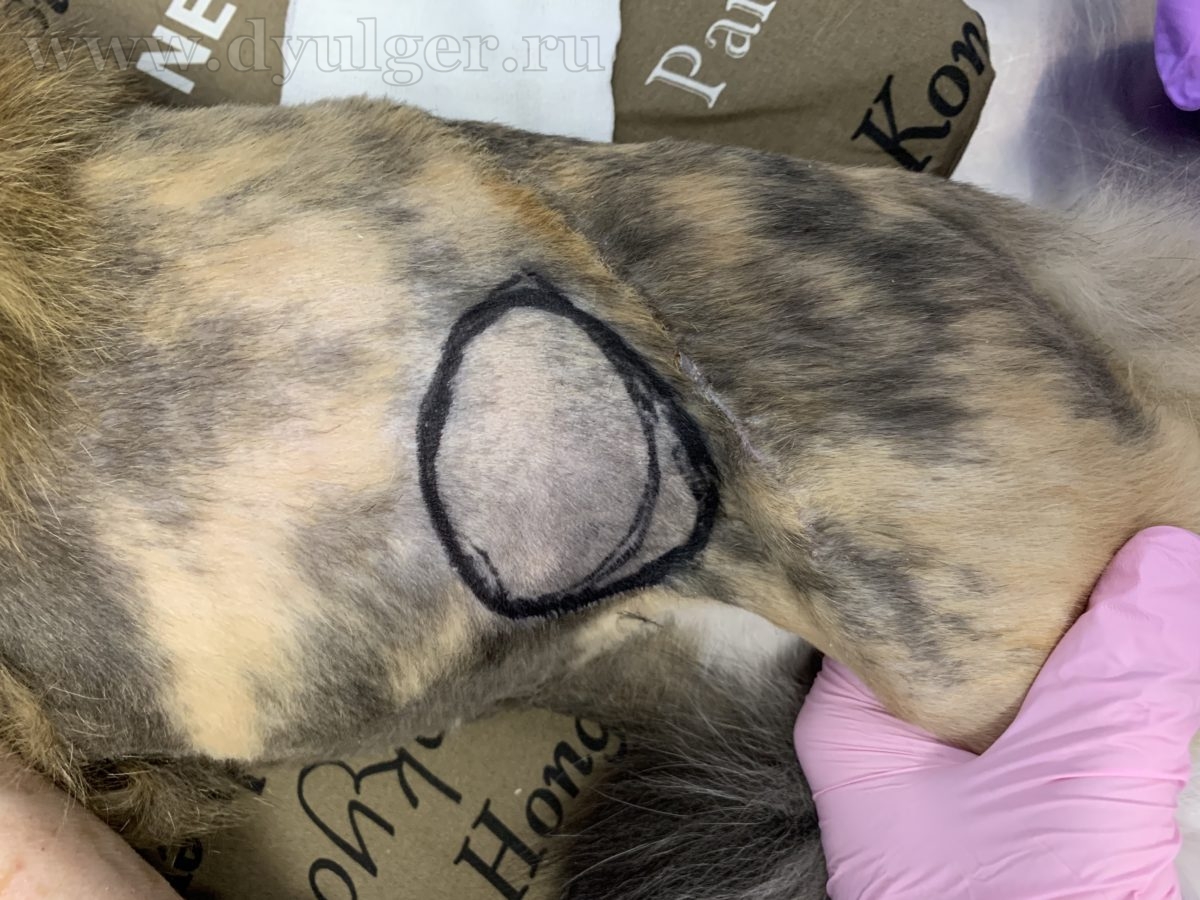
Фото 8. Клинический пример мультимодального подхода к лечению постинъекционной саркомы у кошки. По данным МРТ у данного пациента есть инвазия опухоли в мышцы брюшной стенки, длиннейшие мышцы спины и поясничную фасцию. Из-за невозможности радикального удаления опухоли, было принято решение о широкой резекции новообразования и использования облучения и метрономной химиотерапии в адъювантном режиме. На фото слева на право: внешний вид новообразования, послеоперационный шов и момент планирования границ облучения через 2 недели после операции.
После операции удаленною опухоль обязательно исследуют в лаборатории патоморфологии для определения типа опухоли, проведения иммуногистохимических исследований и оценки «чистоты» границ резекции.
Так при «чистых» границах резекции рецидивы отмечаются только в 19-22% случаев (опухоль обычно рецидивирует через несколько месяцев после операции), а при «грязных» границах резекции повторный рост отмечается в 58-69% случаев (опухоль обычно рецидивирует в короткие сроки после операции) (C. Giudice et al., 2010; V. J. Poirier et al., 2002).
Видеозапись этапов операции
Широкая резекция постинъекционной (поствакцинальной) саркомы
Этапы операции
(1) Хирургическим маркером или электроножом отмечают границы резекции
(2) Внешний вид операционной раны после резекции кожи и подкожных тканей (латеральные границы в этом случае примерно 3-4 сантиметра)
(3) Опухоль удаляется единым блоком вместе с вовлеченными в процесс мышцами: latissimus dorsi, trapezius и cutanius trunci – для достижения двух фасций в глубину
(4-5) Для профилактики расхождения швов (самое часто осложнение) – рану ушивают послойно с соблюдением базовых правил Холстеда
Прогноз
Прогноз при постинъекционных саркомах у кошек различный и зависит от множества факторов — гистологического типа новообрзования, степени дифференцировки опухоли, объема оперативного вмешательства, количества рецидивов новообразования, мультимодальности лечения и ряда других, например:
- Кошки с опухолями расположенными на конечностях имеют более длительную выживаемость, по сравнению с животными у которых саркома располагается на туловище (325 суток против 96 суток, соответственно) (Hershey AE et al. 2000);
- Кошки с диаметром опухоли менее 2 сантиметра имеют медиану продолжительности жизни в 643 дня, по сравнению с медианой в 558 суток у животными с размером опухоли 2-5 сантиметров, а кошки с опухолями более 5 сантиметров имеют медиану в 394 дня (Dillon CJ et al. 2005);
- Если животное оперируется в узкопрофильном учреждении или у неспециализированного специалиста, время безрецидивного периода составляет 274 и 66 суток, соответственно (Hershey AE et al. 2000);
- Если после операции обнаруживаются «грязные» края резекции, то безрецидивный период составляет 112 суток, а если опухоль удалена с «чистыми» краями, то безрецидивный период достигает 700 суток (Cronin K et al. 1998);
Медиана продолжительности жизни варьируется от 390 до 901 суток при хирургическом лечении (+/- химиотерапия). Мультмодальный подход к лечению может увеличить продолжительность жизни до более чем 1000 суток (J. Ladlow, 2013).
| Источник | Дата публикации | Количество кошек | Медиана безрецидивного периода | Медиана продолжительности жизни |
|---|---|---|---|---|
| Cronin et al. | 1998 | 33 | 398 суток | 600 суток |
| Cohen et al. | 2001 | 78 | 405 суток | 730 суток |
| Bregazzi et al. | 2001 | 25 | 661 сутки | 701 сутки |
| Kobayashi et al. | 2002 | 92 | 584 дня | — |
| Hahn et al. | 2007 | 71 | 234 дня | 771 сутки |
| Mayer et al. | 2009 | 24 | — | 310 суток |
| Mayer et al. | 2009 | 55 | — | 705 суток |
| Eckstein et al. | 2009 | 46 | 1110 суток | 1290 суток |
Профилактика развития постинъекционных сарком
На сегодняшний день разработаны клинический рекомендации, направленные на предотвращение и снижение частоты развития постинъекционных сарком у кошек (J. Ladlow, 2013):
- Введение вакцины от бешенства в область или дистальнее правого коленного сустава, лейкоза и иммунодефицита — левого коленного сустава, остальных болезней — правого локтевого сустава;
- Руководство правилом «3-2-1» (удаление постинъекционной гранулемы если она: существует более 3 месяцев, больше 2 сантиметров в диаметре или увеличивается в течение 1 месяца)(фото 9 и 10);
- Отдавать предпочтение пероральному или внутривенному введению лекарственных средств у кошек;
- Информирование владельцев и заводчиков о рисках развития постинъекционных сарком кошек;
- Не вводить вакцины и другие местнораздражающие вещества в область холки;
- Снижение частоты вакцинаций до эффективного минимума.
Частые вопросы по саркомам у кошек
Нет, постинъекционная саркома не передается от кошки к человеку.
Скорее всего это постинъекционная саркома, более подробно о ней можно прочитать в ЭТОЙ статье.
Как правило, такие «шишки» самостоятельно проходят в течение нескольких недель, в ряде случаев требуется назначение антибиотиков и дренаж содержимого «шишки» (если это абсцесс после инъекции).
Однако, если шишка существует больше 3 месяцев или более 2 сантиметров в диаметре или увеличивается в течение 1 месяца, то кошку необходимо показать врачу с хирургической или онкологической специализацией.
Саркома челюсти у кошки (саркома во рту)?
Саркома легких у кошки?
Саркома позвоночника у кошки?
Саркома кости у кошки (саркома лапы)?
Саркома молочной железы у кошки?
Саркома — это собирательный термин для обозначения группы злокачественных новообразований из соединительной ткани. Подход к лечению и прогноз у животных с саркомами различный и зависит от места расположения опухоли, ее гистологического типа и степени злокачественности. В ЭТОЙ статье рассматриваются постинъекционные саркомы (поствакцинальные) кошек.
Литература
Статьи
- K. N. Woodward, “Origins of Injection-Site Sarcomas in Cats: The Possible Role of Chronic Inflammation—A Review,” ISRN Vet. Sci., vol. 2011, pp. 1–16, 2011;
- J. Ladlow, “Injection site-associated sarcoma in the cat: treatment recommendations and results to date.,” J. Feline Med. Surg., vol. 15, no. 5, pp. 409–18, May 2013;
- M. J. Hendrick and M. H. Goldschmidt, “Do injection site reactions induce fibrosarcomas in cats?,” J. Am. Vet. Med. Assoc., vol. 199, no. 8, p. 968, Oct. 1991;
- M. J. Hendrick, M. H. Goldschmidt, F. S. Shofer, Y. Y. Wang, and A. P. Somlyo, “Postvaccinal sarcomas in the cat: epidemiology and electron probe microanalytical identification of aluminum.,” Cancer Res., vol. 52, no. 19, pp. 5391–4, Oct. 1992;
- M. Martano, E. Morello, and P. Buracco, “Feline injection-site sarcoma: Past, present and future perspectives,” Vet. J., vol. 188, no. 2, pp. 136–141, May 2011;
- A. Srivastav, P. H. Kass, L. D. McGill, T. B. Farver, and M. S. Kent, “Comparative vaccine-specific and other injectable-specific risks of injection-site sarcomas in cats,” J. Am. Vet. Med. Assoc., 2012;
- G. M. Gobar and P. H. Kass, “World Wide Web-based survey of vaccination practices, postvaccinal reactions, and vaccine site-associated sarcomas in cats.,” J. Am. Vet. Med. Assoc., 2002;
- C. Saba, “Vaccine-associated feline sarcoma: current perspectives,” Vet. Med. Res. Reports, 2017;
- A. E. Hershey, K. U. Sorenmo, M. J. Hendrick, F. S. Shofer, and D. M. Vail, “Prognosis for presumed feline vaccine-associated sarcoma after excision: 61 cases (1986-1996),” J. Am. Vet. Med. Assoc., 2000;
- G. Romanelli, L. Marconato, D. Olivero, F. Massari, and E. Zini, “Analysis of prognostic factors associated with injection-site sarcomas in cats: 57 cases (2001–2007),” J. Am. Vet. Med. Assoc., 2008;
- H. A. Phelps, C. A. Kuntz, R. J. Milner, B. E. Powers, and N. J. Bacon, “Radical excision with five-centimeter margins for treatment of feline injection-site sarcomas: 91 cases (1998-2002).,” J. Am. Vet. Med. Assoc., vol. 239, no. 1, pp. 97–106, Jul. 2011;
- C. Giudice et al., “Feline injection-site sarcoma: Recurrence, tumour grading and surgical margin status evaluated using the three-dimensional histological technique,” Vet. J., 2010;
- V. J. Poirier et al., “Liposome-encapsulated doxorubicin (Doxil) and doxorubicin in the treatment of vaccine-associated sarcoma in cats,” J. Vet. Intern. Med., 2002;
- Carminato A, Vascellari M, Marchioro W, et al: Microchip-associated fibrosarcoma in a cat. Vet Dermatol 22:565–569, 2011;
- Buracco P, Martano M, Morello E, et al: Vaccine-associated-like fibrosarcoma at the site of a deep nonabsorbable suture in a cat. Vet J 163:105–107, 2002;
- Munday JS, Banyay K, Aberdein D, et al: Development of an injection site sarcoma shortly after meloxicam injection in an unvaccinated cat. J Feline Med Surg 13:988–991, 2011;
- McLeland SM, Imhoff DJ, Thomas M, et al: Subcutaneous fluid port-associated soft tissue sarcoma in a cat. J Feline Med Surg 15:917–920, 2013;
- Haddad JL, Goldschmidt MH, Patel RT: Fibrosarcoma arising at the site of a retained surgical sponge in a cat. Vet Clin Pathol 39:241–246, 2010;
- Hendrick MJ, Books JJ: Postvaccinal sarcomas in the cat: histology and immunohistochemistry. Vet Pathol 31:126–129, 1994;
- Hendrick MJ, Shofer FS, Goldschmidt MH, et al: Comparison of fibrosarcomas that developed at vaccination sites and at nonvaccination sites in cats: 239 cases (1991-1992). J Am Vet Med Assoc 205:1425–1429, 1994;
- Couto SS, Griffery SM, Duarte PC, et al: Feline vaccine-associated fibrosarcoma: morphologic distinctions. Vet Pathol 39:33–41, 2002;
- Doddy FD, Glickman LT, Glickman NE, et al: Feline fibrosarcomas at vaccination sites and non-vaccination sites. J Comp Pathol 114:165– 174, 1996;
- Eckstein C, Guscetti F, Roos M, et al: A retrospective analysis of radiation therapy for the treatment of feline vaccine-associated sarcoma. Vet Comp Oncol 7:54–68, 2009;
- Hershey AE, Sorenmo KU, Hendrick MJ, et al: Prognosis for presumed feline injectionsite sarcoma after excision: 61 cases (1986- 1996). J Am Vet Med Assoc 216:58–61, 2000;
- Dillon CJ, Mauldin GN, Baer KE: Outcome following surgical removal of nonvisceral soft tissue sarcomas in cats: 42 cases (1992-2000). J Am Vet Med Assoc 227:1955–1957, 2005;
- Cronin K, Page RL, Spodnick G, et al: Radiation therapy and surgery for fibrosarcoma in 33 cats. Vet Radiol Ultrasound 39:51–56, 1998.