Сокращения: ПКР — плоскоклеточный рак; ЗМ — злокачественная меланома; КТ — компьютерная томография; МРТ — магнитно-резонансная томография; УЗИ — ультразвуковое исследования; PTHrP — родственные паратиреоидному гормону пептид (PTH related peptide); ЦОГ — циклооксигеназа; МПЖ — медиана продолжительности жизни; МБП — медиана безрецидивного периода.
Частота встречаемости и факторы риска опухолей ротовой полости
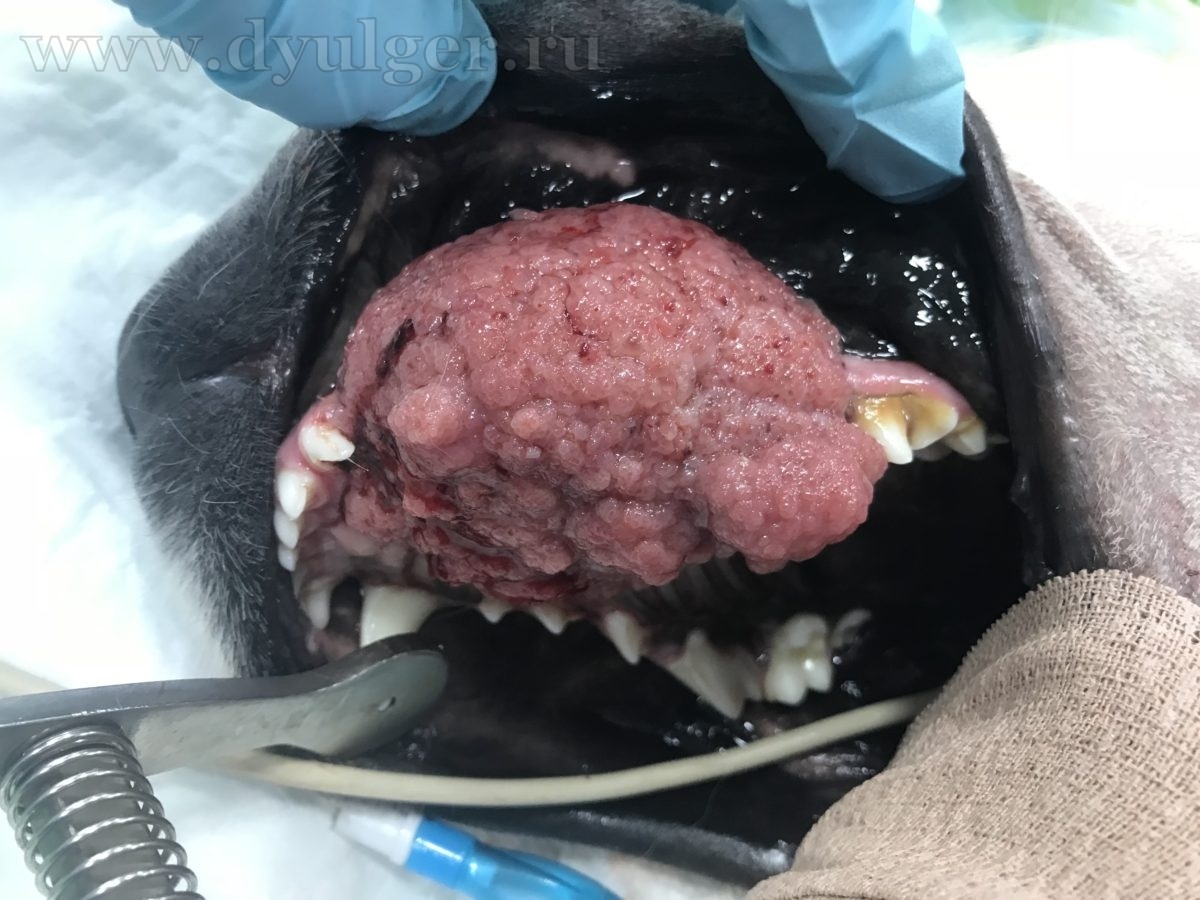
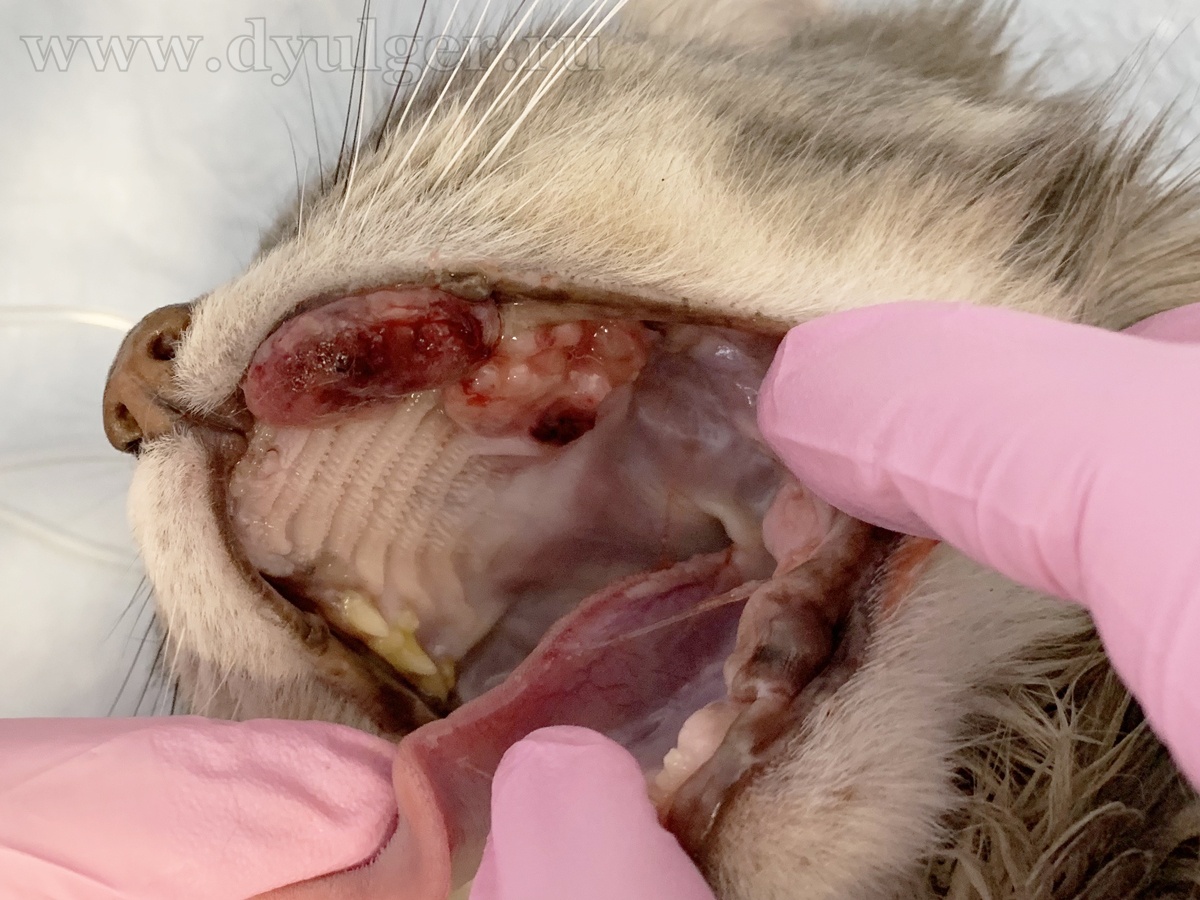
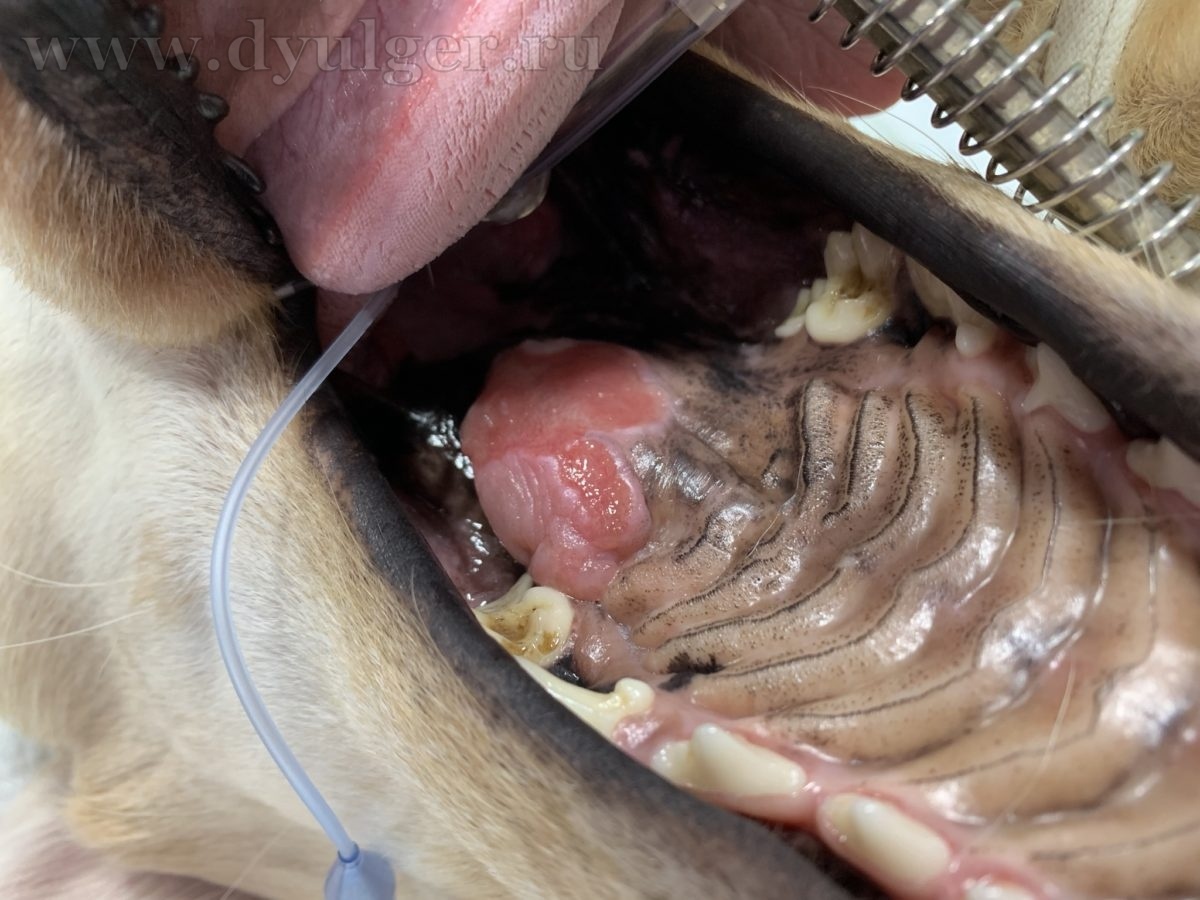
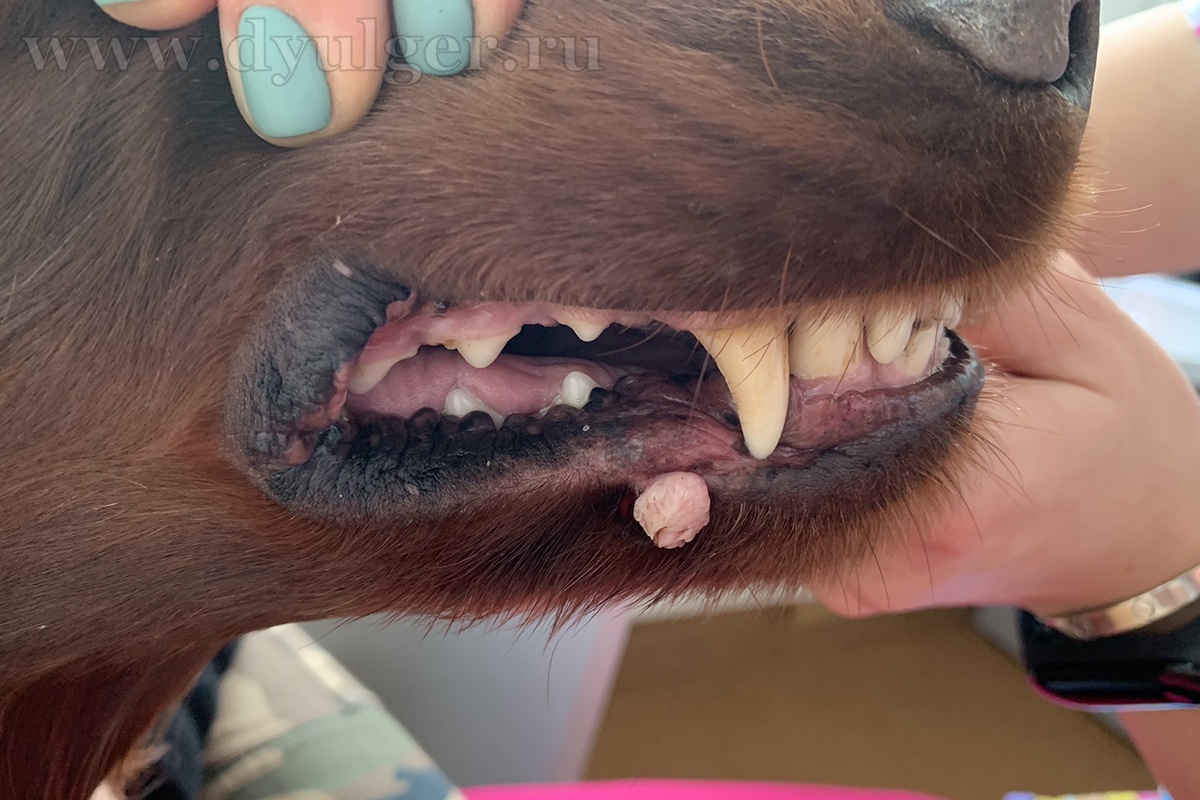
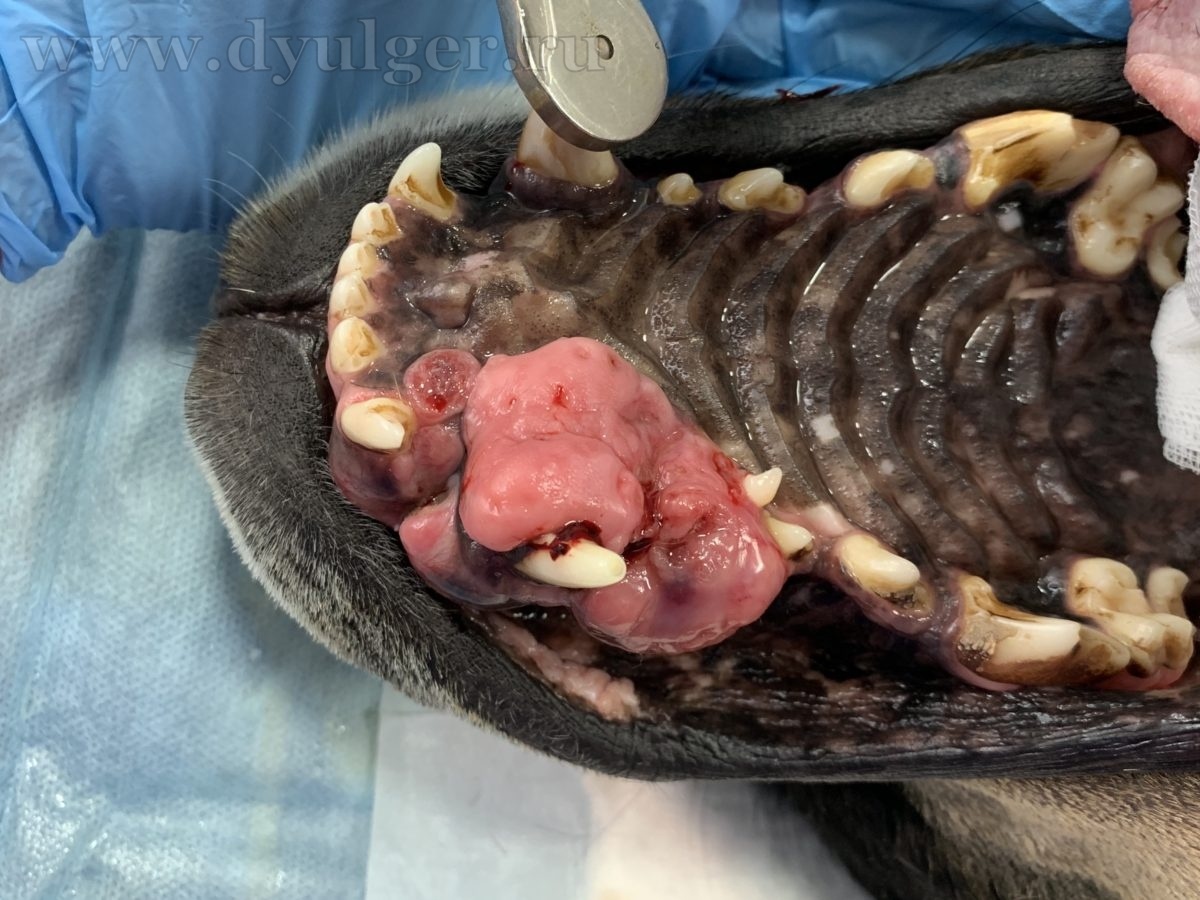
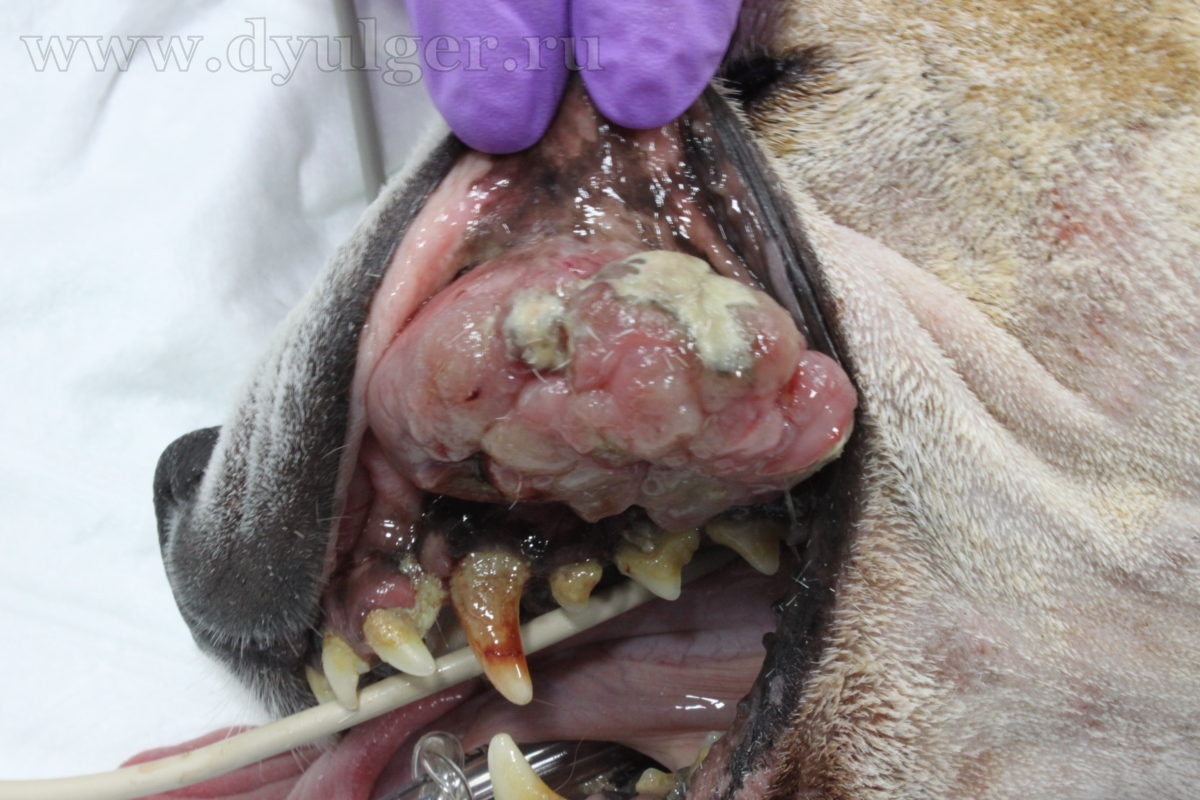
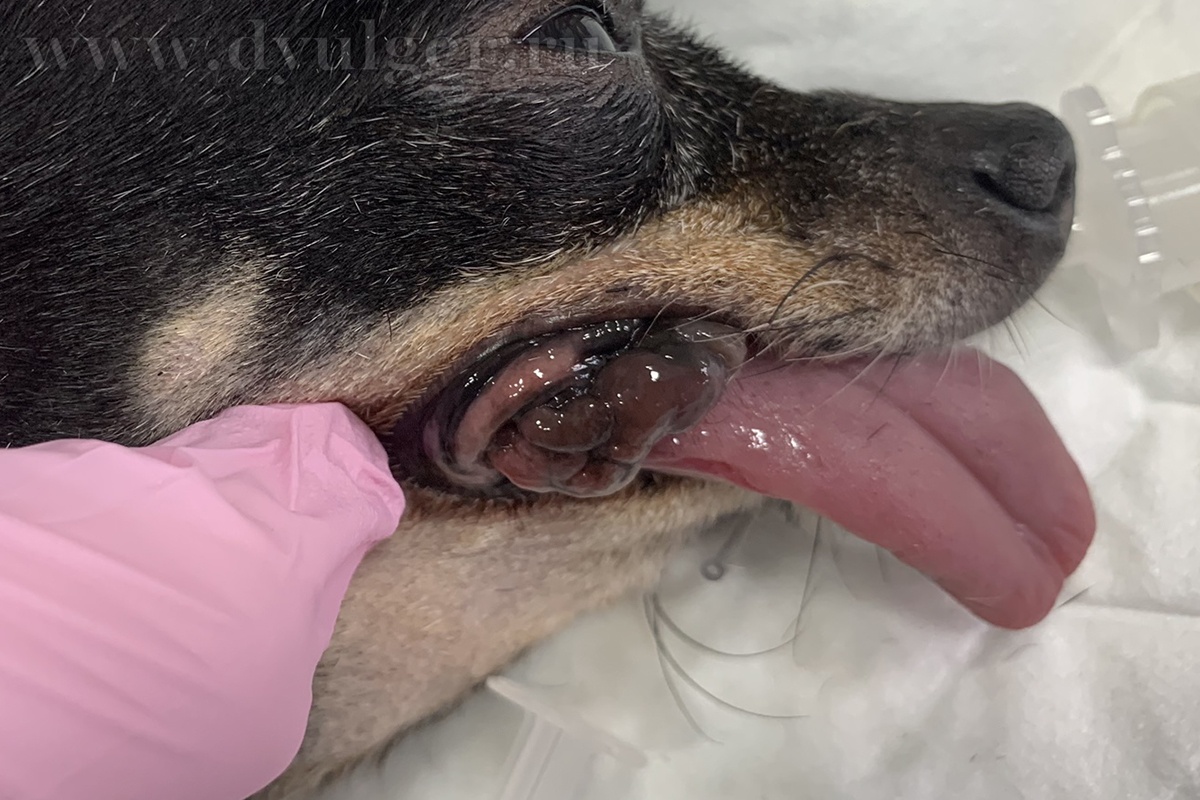
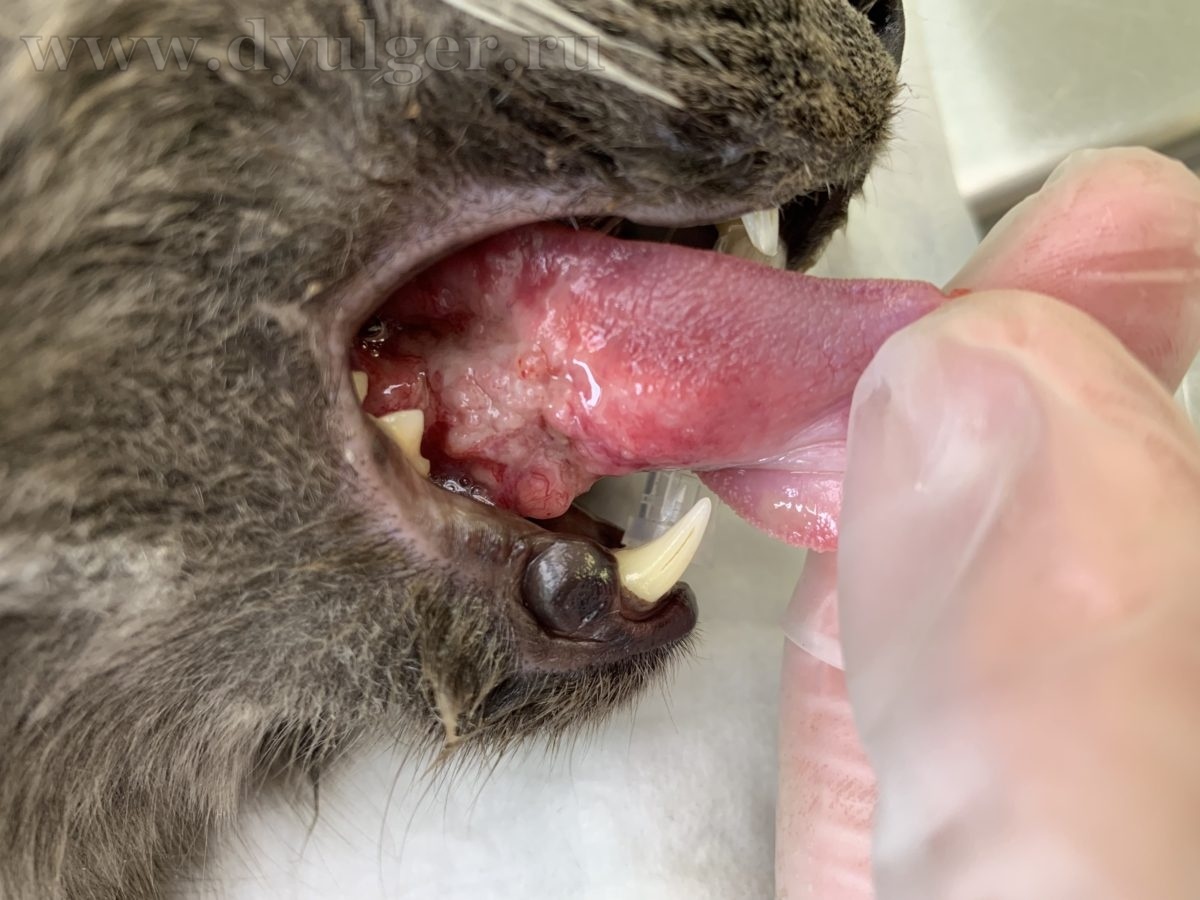
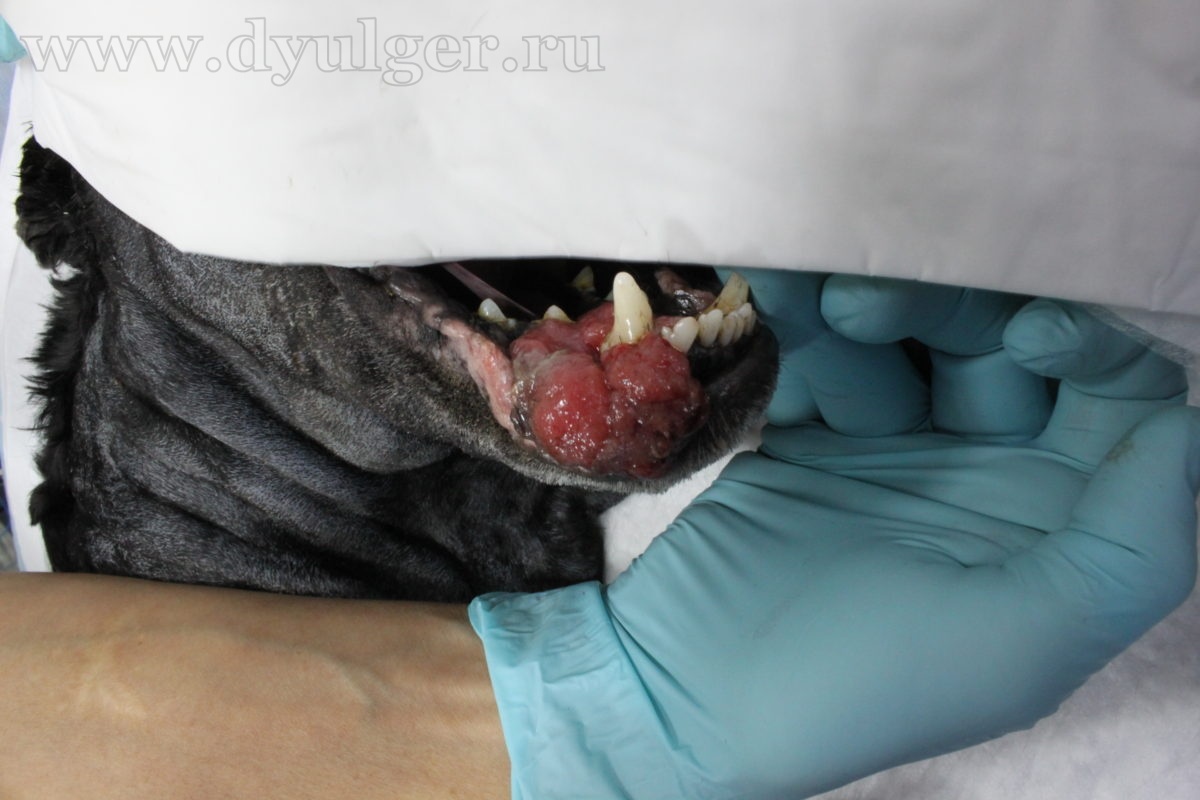
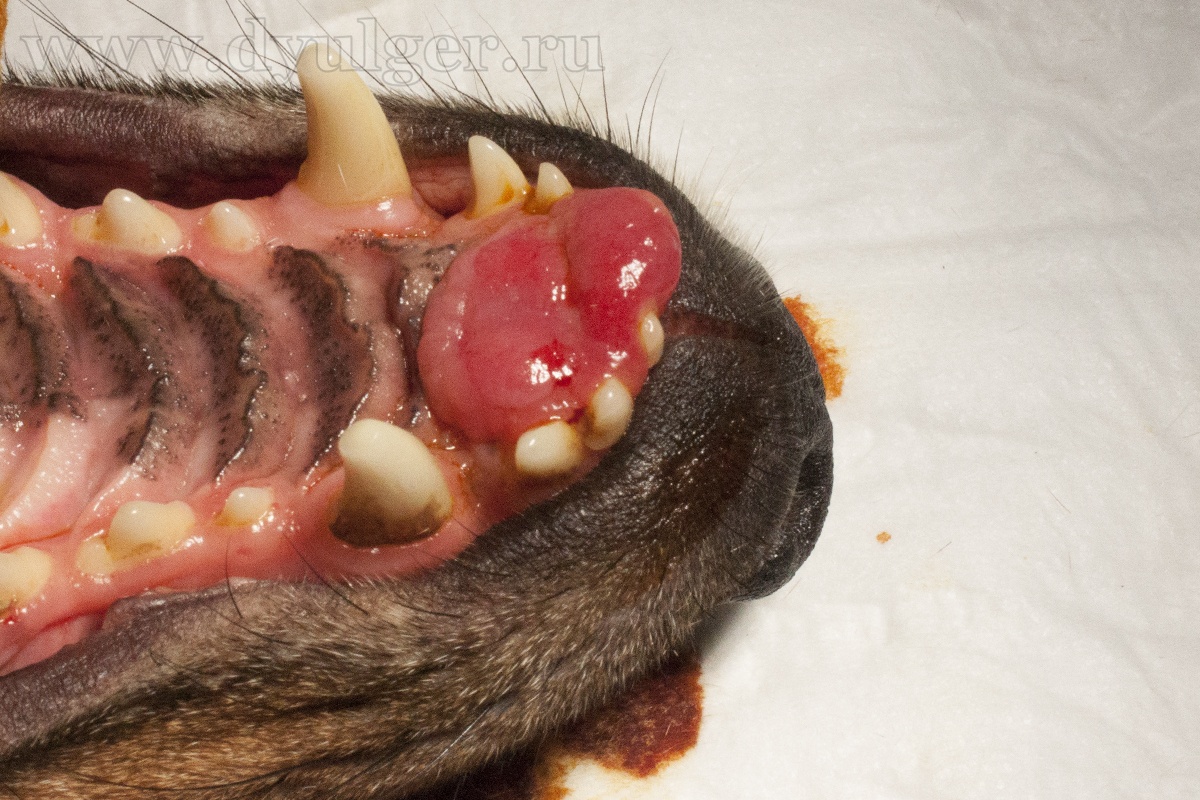
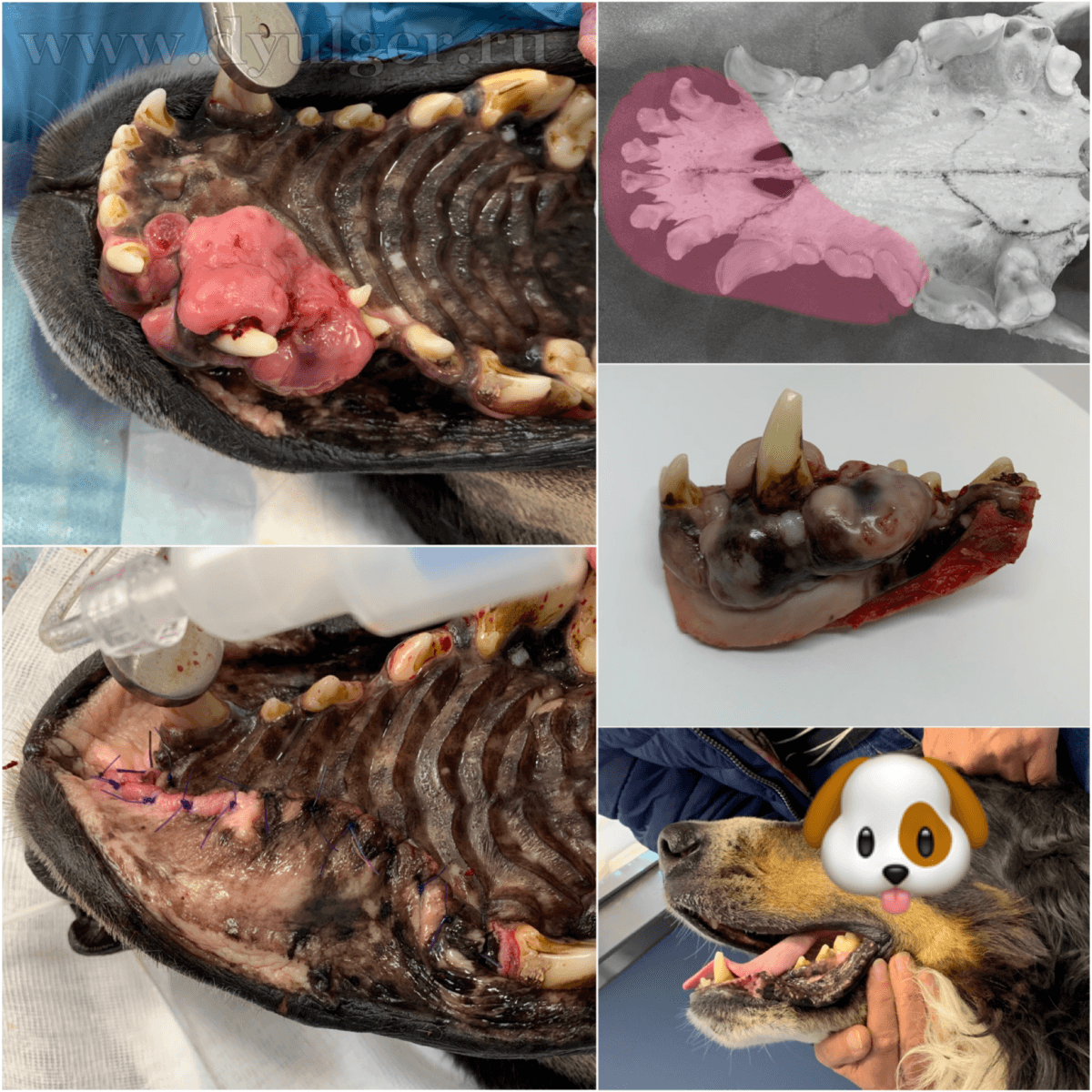
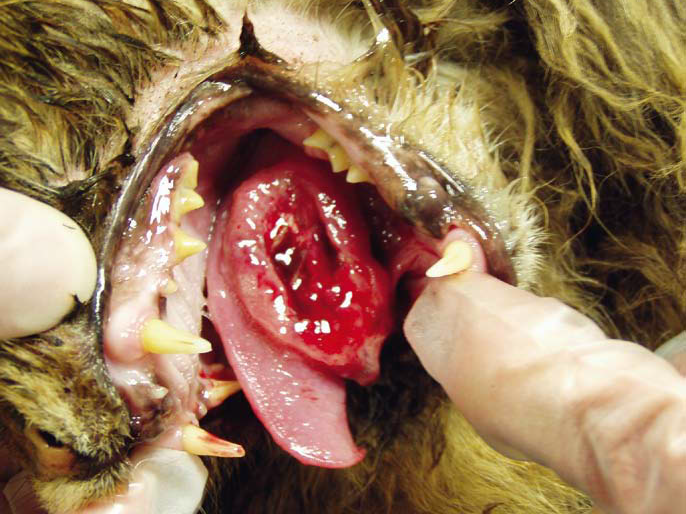
- Опухоли ротовой полости составляю примерно 6-7% от всех встречаемых новообразований у собак и занимают 4 место по распространенности (Hoyt RF, Withrow SJ. 1984; Bronden LB et al. 2009). У кошек опухоли ротовой полости составляют примерно 3% от всех встречаемых новообразований (Stebbins KE et al. 1989)(фото 1-5).
- У собак новообразования ротовой полости встречаются в 2.6 раз чаще чем у кошек, а у кобелей риски развития опухолей в 2.4 раза больше чем у сук (Dorn CR et al. 1968). Кобели также более предрасположены к развитию злокачественных меланом ротовой полости и тонзиллярного плоскоклеточного рака (Cohen D et al. 1964; Kuding ST et al. 2003).
- Породы в группе риска: кокер-спаниели, немецкие овчарки, немецкие курцхаары, веймаранеры, золотистые ретриверы, миниатюрные пудели, чау-чау, боксеры и сеттер-гордоны (Dorn CR, Priester WA, 1976; Ramos-Vara JA et al. 2000).
- Встречаемость опухолей (по убыванию): злокачественная меланома, плоскоклеточный рак и фибросаркома (в ряде исследований плоскоклеточный рак у собак встречается чаще чем меланома)(Todoroff RJ et al. 1979; Withrow SJ et al. 1983; Withrow SJ et al. 1985; White RAS et al. 1985; Bradey RL et al. 1984; Salisbury SK et al. 1988; White RAS, 1991; Kosovsky JK et al. 1991; Wallace J et al. 1992; Schwarz PD et al. 1991). К другим описанным опухолям относят: остеосаркому, хондросаркому, анапластическую карциному, мультилобарную остеохондросаркому, внутрикостную карциному, миксосаркому, гемангиосаркому, лимфому, мастоцитому и трансмиссивную венерическую саркому. У кошек на первом месте стоит плоскоклеточный рак, далее идет фибросаркома.
| Собаки | Кошки | |||||
| Злокачественная меланома | Плоскоклеточный рак | Фибросаркома | Амелобластома | Плоскоклеточный рак | Фибросаркома | |
| Частота встречаемости | 30-40% | 17-25% | 8-25% | 5% | 70-80% | 13-17% |
| Возраст (лет) | 12 | 8-10 | 7-9 | 8 | 10-12 | 10 |
| Половая предрасположенность | Нету-Кобели | Нету | Кобели | Нету | Нету | Нету |
| Размер животного | Мелкие | Крупные | Крупные | Нету | — | — |
| Локализация | Десна, слизистая щеки | Ростральная часть нижней челюсти | Десна на верней челюсти и твердое небо | Ростральная часть нижней челюсти | Язык, глотка и миндалины | Десна |
| Метастазирование в лимфатические узлы | Часто (41-74%) | Редко (до 40%) У тонзиллярного ПКР до 73% | Редко (9-28%) | Нет | Редко | Редко |
| Отдаленные метастазы | Часто (14-92%) | Редко (до 36%) | Возможны (0-71%) | Нету | Редко | Редко (до 20%) |
| Внешний вид | Пигментированная (67%) или беспигментная (33%), изъязвленная | Красного оттенка, по типу «цветной капусты», изъязвленная | Плоская, плотная, изъязвленная | Красного оттенка, по типу «цветной капусты», изъязвленная | Пролиферативная, изъязвленная | Плотная |
| Вовлечение костной ткани | Часто (57%) | Часто (77%) | Часто (60-72%) | Часто (80-100%) | Часто | Часто |
| Хирургическое лечение Рецидивы МПЖ Годичная выживаемость | Средний-Хороший 0-59% 5-17 месяцев 21-35% | Хороший 0-50% 9-26 месяцев 57-91% | Средний-Хороший 31-60% 10-12 месяцев 21-50% | Хороший 0-11% более 24-64 месяцев 72-100% | Плохой 45 суток менее 10% | Плохой |
| Ответ на лучевую терапию % ответа Рецидивы МПЖ Годичная выживаемость | Хороший 83-94% 11-27% 4-12 месяцев 36-71% | Хороший — 31-42% 16-36 месяцев 72% | Плохой — 32% 7-26 месяцев 76% | Хороший — 8-18% 37 месяцев Более 85% | Плохой 90 суток | Плохой |
| Терапия выбора | Хирургия и/или лучевая терапия +/- химиотерапия +/- иммунотерапия | Хирургия и/или лучевая терапия | Хирургия и/или лучевая терапия | Хирургия | Хирургия и/или лучевая терапия с сенситизацией | Хирургия и/или лучевая терапия |
| Прогноз | Осторожный-Плохой | Осторожный | Осторожный | Хороший | Плохой | Плохой |
| Медиана продолжительности жизни | До 36 месяцев | 26-36 месяцев | 18-26 месяцев | Более 64 месяцев | 14 месяцев | — |
| Причина смерти | Отдаленные метастазы | Локальное распространение или отдаленные метастазы | Локальное распространение опухоли | Редко связана с опухолью | Локальное распространение болезни | Локальное распространение болезни |
Патологическая характеристика и биологическое поведение опухолей ротовой полости
В ротовой полости может встречаться большое количество разнообразных доброкачественных и злокачественных новообразований. В этой статье мы разберем более подробно самые распространенные новообразования.
Злокачественная меланома ротовой полости
Злокачественная меланома более распространена среди мелких пород собак (фото 6-7). Породы в группе риска: миниатюрные пудели, кокер-спаниели, турецкий кангал, чау-чау, гордонский сеттер и золотистый ретривер. Несколько более предрасположены к заболеванию кобели. Средний возраст заболевших собак составляет 11.4 года. Злокачественная меланома описана и у кошек, однако встречается крайне редко.
В ряде случаев, если образец не содержит меланин, постановка гистологического диагноза может вызвать затруднения (беспигментные меланомы встречаются примерно в 1/3 случаев). Гистологический диагноз недифференцированной или анапластичной карциномы или эпителиального рака должен интерпретироваться с осторожностью, так как это может быть беспигментная форма меланомы. Для дифференцировки опухолей может потребоваться иммуногистохимическое исследование с использованием меланина А.
Злокачественная меланома ротовой полости является крайне агрессивной опухолью с высокой частотой метастазирования в лимфатические узлы и легкие (Overley B et al. 2001; William LE, Pacer RA. 2003). Метастазирование во многом зависит от размера, места, стадии болезни и может достигать 80% случаев. Злокачественная меланома относится к иммуногенным опухолям и существуют разработки специализированных противоопухолевых вакцин и иммуномодуляторов, о которых более подробно мы поговорим в отдельной статье посвященной меланоме (Blackwood L et al. 1996; MacEwen EG et al. 1986; MacEwen EG et al. 1999; Owen LN. 1980; Prolux DR et al. 2003; Hahn KA et al. 1994; Moore AS et al. 1991; Elmsile RE et al. 1995; Dow SW et al. 1998; Hogge G et al. 1998; Quintin-Colonna F et al. 1996; Bergman PJ et al. 2003; Bergman PJ et al. 2004; Modiano JF et al. 1999; Sulaimon SS et al. 2003).
| Клиническая классификация опухолей ротовой полости | |
|---|---|
| Первичная опухоль (T) | |
| Tis T1a T1b T2 T2a T2b T3 T3a T3b | Опухоль in situ Опухоль до 2 см в диаметре Без признаков инвазии в кость Есть инвазия в кость Опухоль 2-4 см в диаметре Без признаков инвазии в кость Есть инвазия в кость Опухоль более 4 см Без признаков инвазии в кость Есть инвазия в кость |
| Регионарные лимфатические узлы (N) | |
| N0 N1 N1a N1b N2 N2a N2b N3 | Метастазы в лимфатических узлах отсутствуют Подвижные ипсилатеральные лимфоузлы Нет признаков метастазирования в лимфоузел Есть Признаки метастазирования в лимфоузлы Подвижные контралатеральные лимфоузлы Нет признаков метастазирования в лимфоузел Есть признаки метастазирования в лимфоузел Фиксированные лимфоузлы |
| Отдаленные метастазы (M) | |
| M0 M1 | Отдаленные метастазы не обнаружены Отдаленные метастазы приличествуют |
| Стадия | Опухоль (T) | Лимфоузлы (N) | Метастазы (M) |
|---|---|---|---|
| I | T1 | N0, N1a, N2a | M0 |
| II | T2 | N0, N1a, N2a | M0 |
| III | T3 Любое T | N0, N1a, N2a N1b | M0 M0 |
| IV | Любое T Любое T | N2b, N3 Любое N | M0 M1 |
Плоскоклеточный рак ротовой полости
Плоскоклеточный рак ротовой полости первая по частоте встречаемости опухоль у кошек и вторая у собак (фото 8-9). У кошек риск развития ПКР возрастает в 3.5 раза при использовании ошейников от блох и употреблении консервированной пищи в целом (особенно консервированного тунца) (Bertone ER et al. 2003). Пассивное вдыхание табачного дыма увеличивает риск развития плоскоклеточного рака ротовой полости у кошек в 2 раза, а также значительно увеличивает экспрессию протоонкогена p53 в клетках плоскоклеточного рака по сравнению с контрольной группой (Snyder LA et al. 2004). Вероятно мутация гена p53 является одним из факторов развития и прогрессирования индуцированного табачным дымом плоскоклеточного рака ротовой полости у кошек.
ПКР ротовой полости часто инвазирует окружающие кости у собак и кошек. Экспрессия клетками ПКР пептида PTHrP у кошек может способствовать резорбции костной ткани с дальнейшей ее инвазией опухолевыми клетками (Martin CK et al. 2011). Есть также публикации о развитии паранеопластической гиперкальциемии у 2 кошек с ПКР ротовой полости (Hutson CA et al. 1992). Метастазирование у кошек отмечается редко, так как гибель наступает как правило из-за локального прогрессирования опухоли. Частота метастазирования ПКР у собак (за исключение тонзиллярной формы) составляет примерно 20%, которая зависит от локализации опухоли — для более рострально расположенных новообразований характерно более низкая частота метастазирования (тонзиллярная форма ПКР характеризуется самой высокой частотой метастазирования).
Фибросаркома ротовой полости
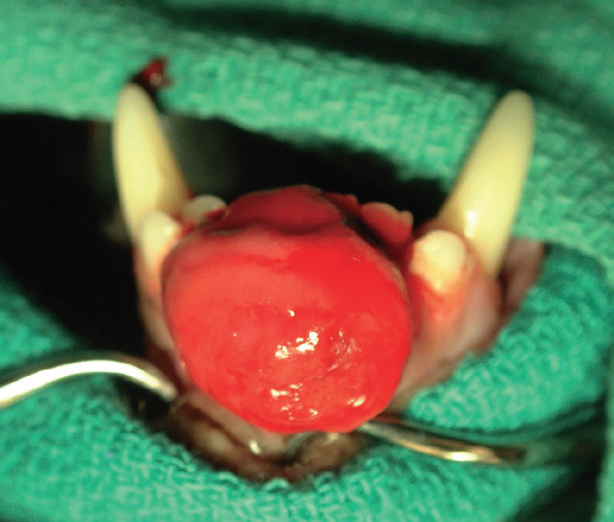
Фибросаркома (фото 10-11) занимает второе место по частоте встречаемости среди всех опухолей ротовой полости у кошек и третье место у собак (Ciekot PA et al. 1994). Фибросаркома ротовой полости имеет тенденцию к развитию у собак крупных пород, особенно золотистых и лабрадор ретриверов; в относительно молодом возрасте с медианой в 7.3-8.6 лет. Фибросаркома может иметь доброкачественную гистологическую характеристику, что в ряде случаев может привести к затруднению в дифференциации фибромы от высокодифференцированной фибросаркомы. Для данной опухоли характерна локализация в области твердого неба и верхней челюсти в области моляров и премоляров у крупных пород собак (используется термин гистологически доброкачественная, но биологически злокачественная фибросаркома). Фибросаркома локально инвазивная опухоль с низкой частотой метастазирования (до 30%).
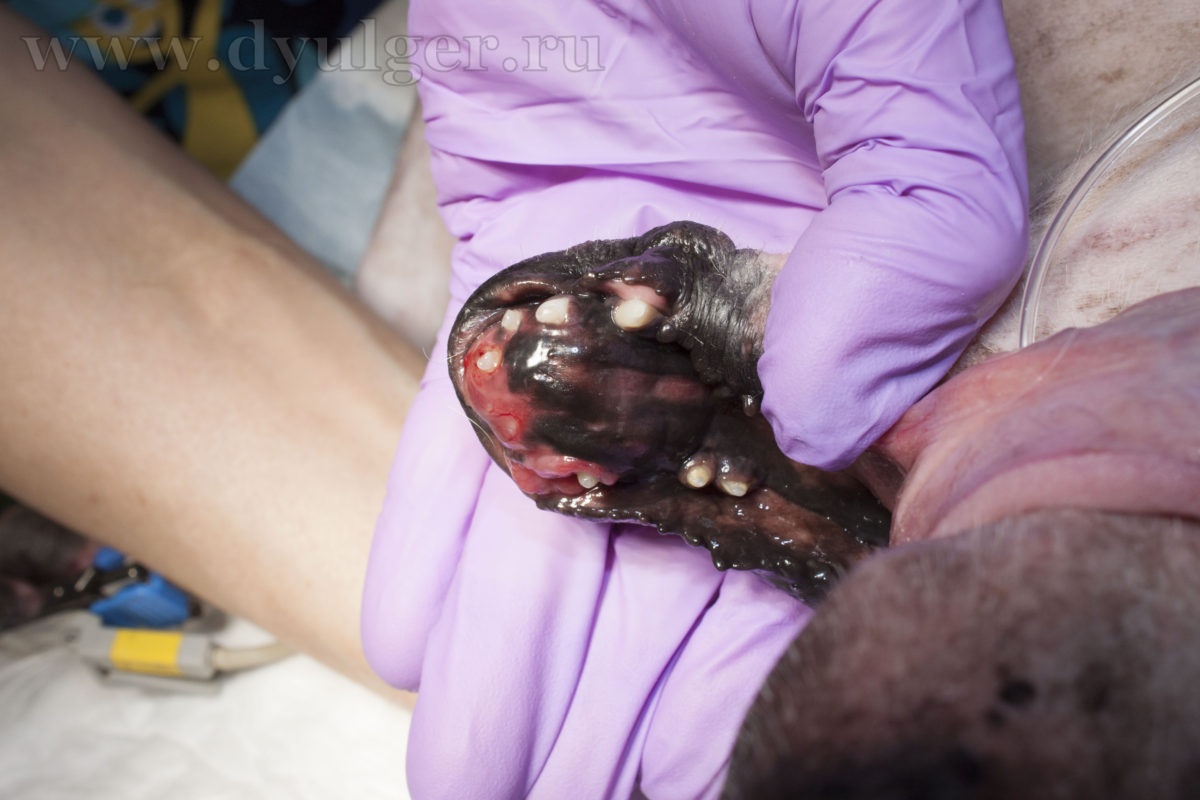
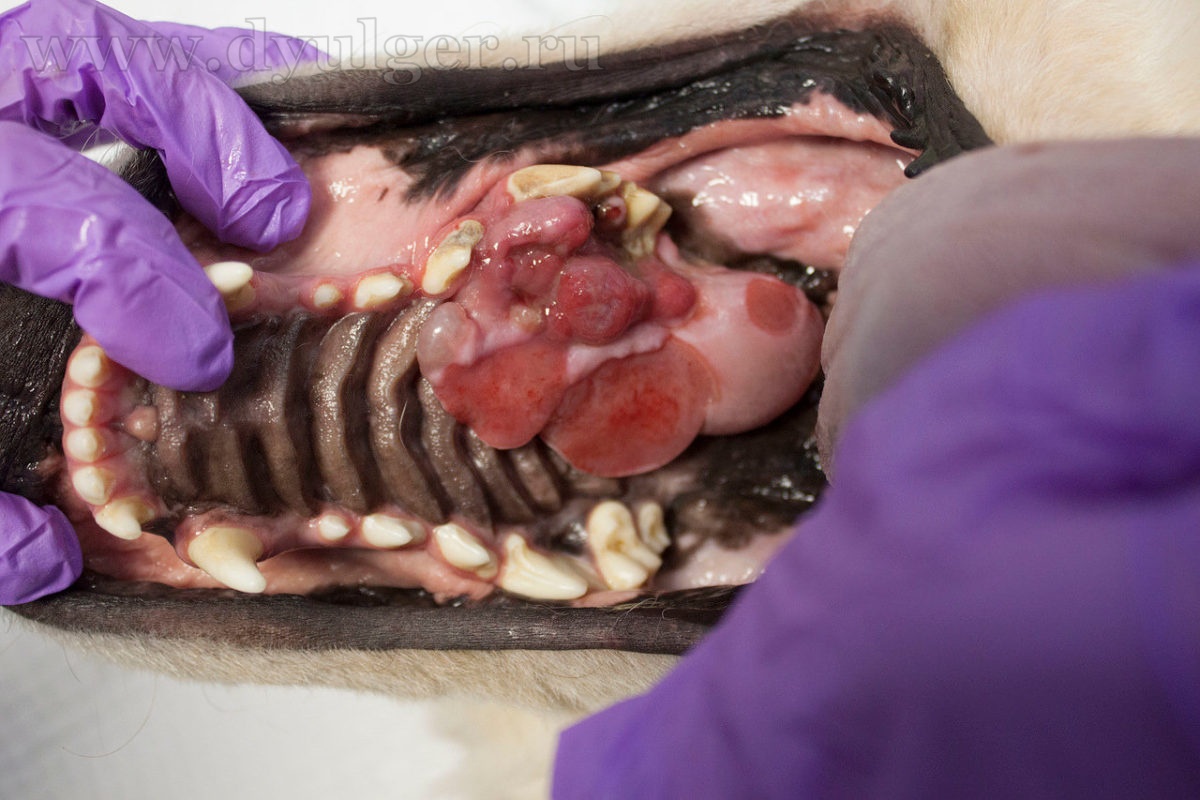
Эпулисы
Под эпулисами подразумевают доброкачественную пролиферацию тканей в области десны, которая берет свое начало от периодонтальной связки и выглядят схоже с гиперплазией десны. У собак описано три вида эпулисов: акантоматозный, фиброматозный и оссифицирующий (Dubielzig RR, 1982; Bjorling DE et al. 1987; Yoshida K et al. 1999). Однако со временем терминология изменилась, акантоматозный эпулис теперь называют акантоматозной амелобластомой, а фиброзный или оссифицирующий эпулис — периферической одонтогенной фибромой (Fiani N. et al. 2011).
Периферическая одонтогенная фиброма
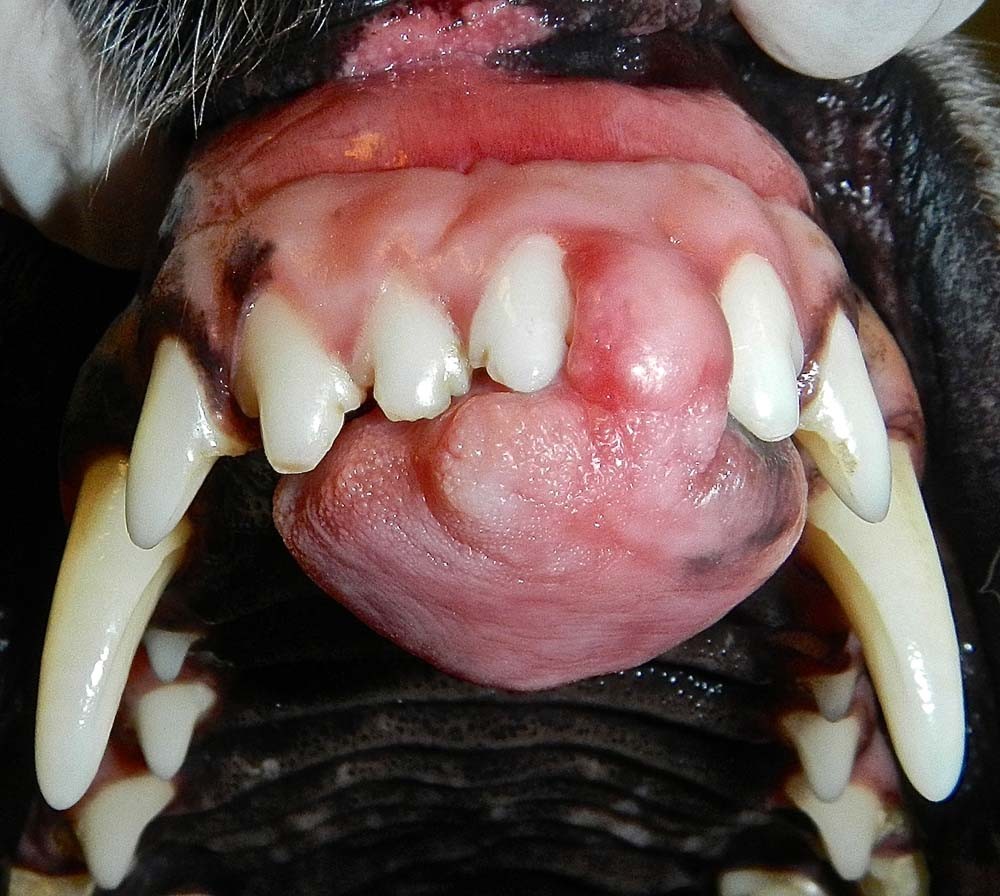
Эпулисы (фото 12) относительно часто встречаются у собак и редко у кошек. Множественные эпулисы описаны у кошек и более половины случаев встречаются у молодых животных до 3 летнего возраста (Colgin LMA et al. 2001). Средний возраст собак с периферическими одонтогенными фибромами составляет 8-9 лет. Для этих новообразований характерен медленный рост и плотная текстура, которая покрыта нормальным эпителием. Они часто располагаются в области 3 премоляра верхней челюсти.
Акантоматозная амелобластома
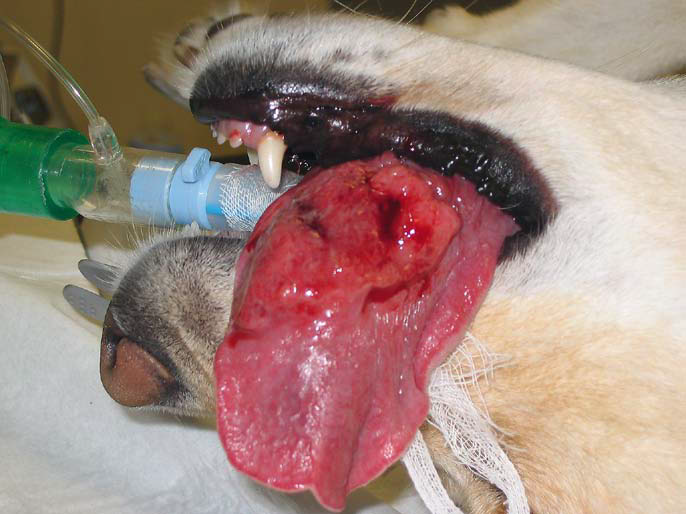
Для данной опухоли характерен инвазивный локальный рост с инвазией в кости верхней и нижней челюсти (фото 13). Средний возраст заболевания составляет 7-10 лет (Thrall DE, 1984). Самое частое место локализации — ростральная часть нижней челюсти. Метастазирование не описано. Акантоматозную амелобластому некоторые патологи могут именовать акантоматозным эпулисом или адамантиномой.
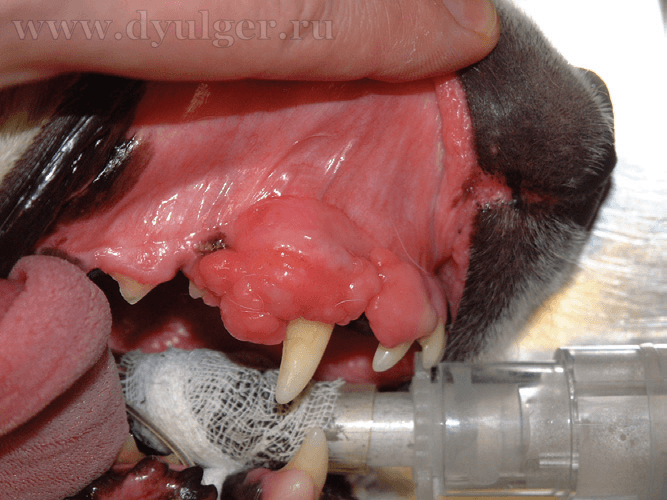
Постановка диагноза у животных с опухолями ротовой полости
Анамнез и клиническая картина
Большинство собак и кошек с новообразования ротовой полости поступают на прием к врачу по поводу опухоли, которую обнаружил владелец. Животные с более каудально расположенными опухолями могут поступать на прием к врачу по поводу затрудненного дыхания, глотания, саливации, кровотечения из ротовой полости, анорексии, потери веса, шейной лимфаденопатии и болезненности при открывании ротовой полости (Reeves NCP et al. 1993). Паранеопластические синдромы редко встречаются у животных с опухолями ротовой полости, однако описано развитие гиперкальциемии у 2 кошек с ПКР и одной с десневой сосудистой гамартомой (Dhaliwal RS et al. 1998).
Диагностические мероприятия
Постановка диагноза у животных с новообразованиями ротовой полости является ключевым моментом, так как подход к лечению и прогноз сильно зависят от конкретного вида опухоли. Если у животного подозревают злокачественную опухоль, то имеет смысл до биопсии провести рентгенографию органов грудной клетки и оценку состояния лимфатических узлов. Наиболее часто метастазирование отмечается у животных со злокачественной меланомой и плоскоклеточным раком каудальной части ротовой полости. В ряде случаев для детальной клинической оценки ротовой полости, проведения биопсии и визуальных методов исследования может потребоваться кратковременная анестезия/седация.
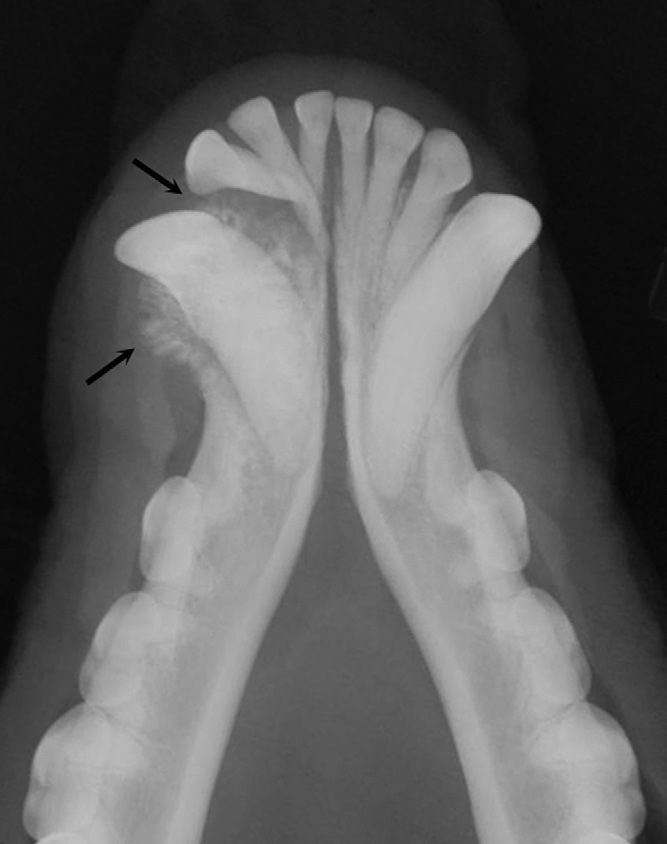
У животных с подозрением на вовлечение в процесс костной/нервной ткани может потребоваться проведение рентгенография в нескольких проекциях, компьютерной или магнитно-резонансная томография (фото 14-16). Недостатком рентгенографии является ее низкая чувствительность (вовлечение костей заметно только после разрушения более 40% костной ткани), поэтому нормальная рентгенограмма не исключает вовлечение в опухолевый процесс костей. Для оценки степени вовлечения в процесс костей и дальнейшего планирования хирургической операции у животных с опухолями ротовой полости рекомендовано проведение компьютерной томографии (Dhaliwal RS et al. 1998; Gendler A. et al. 2010).
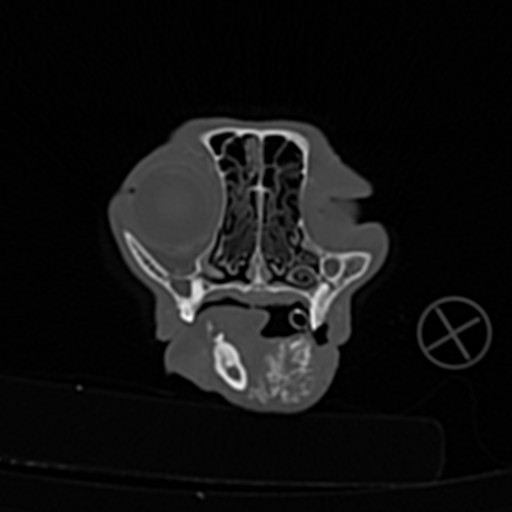

Важно провести оценку состояния регионарных лимфатических узлов. Интерпретировать состояние лимфатических узлов стоит с осторожностью. По данным одного исследования злокачественной меланомы ротовой полости у собак, 40% животных с нормальными лимфатическими узлами имели в них метастазы по данным биопсии, верно и обратное — 49% собак с увеличенными лимфатическими узлами не имели по данным биопсии признаков метастазирования. К регионарным лимфатическим узлам относят: нижнечелюстные, околоушные и медиальные заглоточные (последние 2 пары пальпаторно в норме не определяются). Биопсию лимфоузлов стоит проводить у всех животных со злокачественными новообразованиями ротовой полости (вне зависимо от их клинического состояния)(Smith MM, 1995; Herring ES et al. 2002; Lurie DM et al. 2006).
Последним этапом (в течении однократного эпизода анестезии) проводят инцизионную биопсию. Аспирационную или другие аналогичные методы биопсии не стоит проводить у животных с новообразованиями ротовой полости из-за выраженного воспаление и некроза, характерных для данных опухолей, что делает данные методы исследования ненадежными. Биопсия необходима для определения точного вида опухоли и степени ее дифференцировки, что позволит подобрать оптимальное лечение для животного и определить прогноз. Небольшие новообразования (папилломы, эпулисы и другие) возможно удалить методом эксцизионной биопсии и совместить диагностику с лечением. В остальных случаях лучше дождаться результатов биопсии, провести визуальные методы исследования и спланировать хирургическую резекцию новообразования.
Лечение опухолей ротовой полости
Хирургия
Основным способом локального лечения опухолей ротовой полости является хирургическая резекция и лучевая терапия. Хирургическая операция является эффективным и недорогим способом лечения. Объем хирургического вмешательства зависит от вида опухоли. За исключением ряда доброкачественных новообразований, в большинстве случаев в процесс вовлекается костная ткань, что делает необходимым для надежного контроля за опухолью проведение максиллэктомии, мандибулэктомии или других схожих операций (в большинстве случаев такие операции хорошо переносятся животными)(Kirpensteji J et al. 1994; Lascelles BD et al. 2003; Lascelles BD et al. 2004; Fox LE et al. 1997).
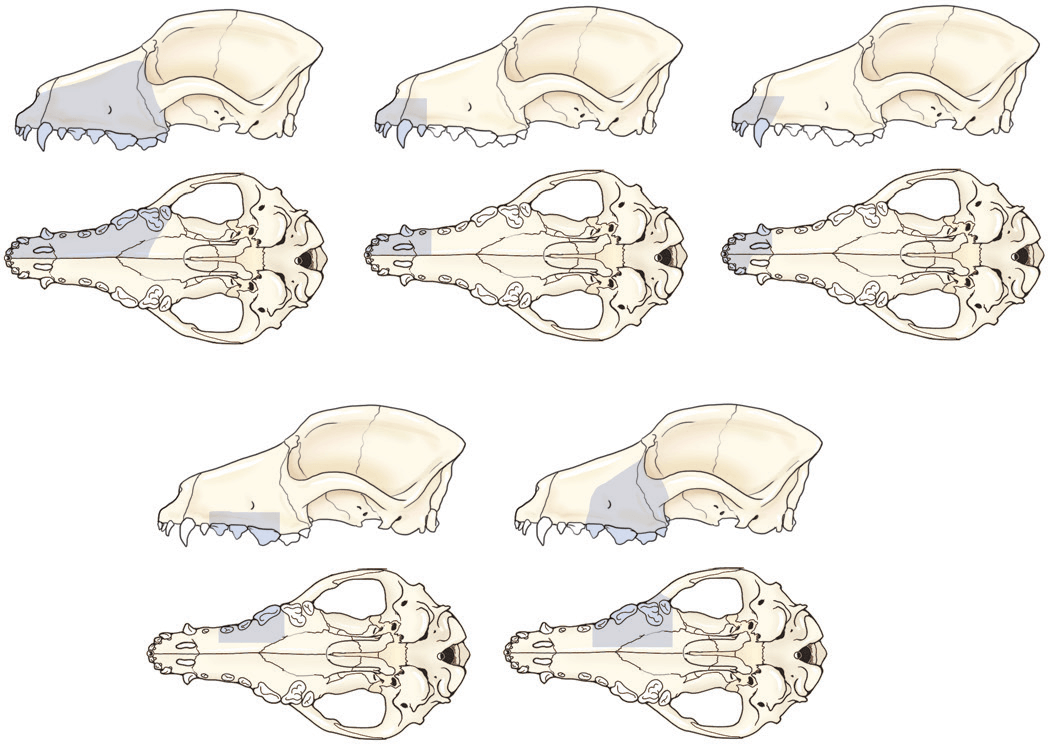
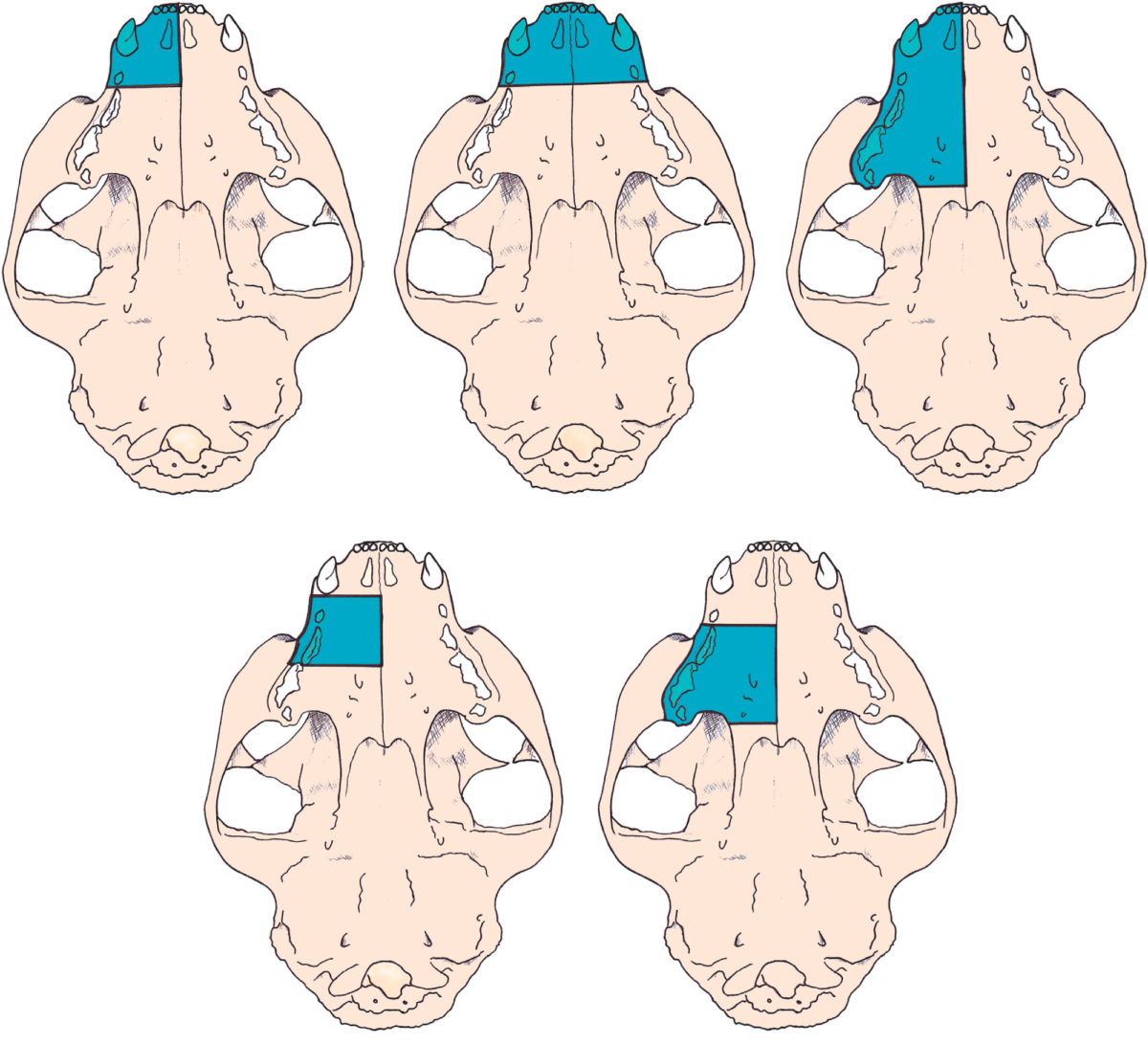
Для надежного контроля за опухолью (злокачественная меланома, фибросаркома, плоскоклеточный рак) рекомендовано проводить широкую резекцию новообразования (отступ от границ опухоли минимум 2 см). Реконструкция резецированного фрагмента нижней или верхней челюсти возможна, но редко необходима (Boudrieau RJ et al. 1994; Boudrieau RJ et al. 2004; Bracker KE, Trout NJ, 2000). Менее радикальные резекции возможны при удалении доброкачественных новообразований или рострально расположенным ПКР у собак. Объемные резекции в виде гемимандибулэктомии, гемимаксиллэктомии, орбитэктомии и радикальной максиллэктомии необходимы для резекции объемных злокачественных новообразований, таких как фибросаркома или каудально расположенных новообразований. Несмотря на такие объемные резекции, косметический и функциональный результат остаются хорошими и большинство владельцев довольны своим выбором (Northrup NC et al. 2006). Заметное функциональное нарушение могут вызывать резекции в виде билатеральной ростральной мандибулэктомии и радикальной максиллэктомии.
Основными интраоперационными осложнениями являются: потеря крови и гипотензия, особенно при проведении каудальных резекций. Описанные послеоперационные осложнения: несостоятельность швов, кровотечение, гиперсаливация, медиальное смещение нижней челюсти, нарушение прикуса и затруднение в приеме пищи (Bar-Am Y, Verstraete FJM, 2010).
В ряде случаев у собак для нормального энтерального питания после операции может потребоваться установка пищевого зонда. Однако такая необходимость возникает редко. Установка зондов часто бывает необходима кошкам, которые могут некоторое время (до нескольких месяцев) адаптироваться к приему пищи после удаления части верхней или нижней челюсти.
Локальный контроль за опухолью является основной целью при лечении большинства злокачественных опухолей у собак и кошек. Резекция регионарных лимфоузлов помогает определить стадию заболевания, однако терапевтическая ценность таких операций до конца неизвестна (Smith MM, 1995; Herring ES et al. 2002).
Криохирургию можно проводить для удаления опухолей небольшого диаметра (2 см) без или с минимальной инвазией в кость. Более объемные опухоли лучше удалять хирургическим путем
Видео 1. Клинический случай максиллэктомии у собаки.
Облучение
Лучевая терапия может быть эффективным методом локального контроля опухолей ротовой полости у собак и кошек. Облучение можно использовать в качестве монотерапии или комбинировать с хирургической операцией (для уменьшения опухоли в размере или при неполных границах резекции).
Злокачественная меланома, ПКР у собак и амелобластома считаются чувствительными опухолями к лучевой терапии и могут быть рассмотрены в качестве первичного метода лечения (Theon AP et al. 1997; Fidel JL et al. 2007). Описаны протоколы по 2.7-4.2 Гр за фракцию с общей дозой в 48-57 Гр (Forrest LJ et al. 2000). Наиболее хороший ответ наблюдается для опухолей небольшого размера (T1 и T2).
Локальный контроль за опухолью может быть улучшен при сочетании облучения и хирургии или химиотерапии, особенно при лечении таких опухолей как фибросаркома или ПКР у кошек (Thrall DE, 1981; Evans SM et al. 1991; LaRue SM, 1991; Ogilvie GK et al. 1993; Jones PD et al. 2003; Fidel J et al. 2011; Turrel JM, 1987; Overgaard J et al. 1986). Для лучшего ответа на лучевую терапию могут быть использованы радиосенсибилизаторы — этанидазол (кошки с ПКР) и препараты платины (собаки с ЗМ)(LeBlanc AL et al. 2004).
Острые побочные реакции отмечаются часто, однако они как правило проходят самостоятельно. К ним относят: мукозит, дисфагию, блефарит, конъюнктивит, кератит и увеит (Roberts SM et al. 1987; Jamieson VE et al. 1991; LaRue SM, Gillette EL, 2001). Отдаленные осложнения лучевой терапии встречаются примерно в 5% случаев, к которым относят: алопецию, кожный фиброз, некроз костной ткани, формирование фистулы, развитие сухого кератоконъюнктивита, катаракты и атрофии сетчатки (Thrall DE et al. 1981).
Химиотерапия
Химиотерапию рекомендуют проводить животным с опухолями с высоким метастатическим потенциалом (меланома, тонзиллярный ПКР). Описана повышенная экспрессия ЦОГ-2 клетками ПКР у кошек, однако применение противовоспалительных лекарств (пироксикама) не показало своей эффективности (DiBernardi L et al. 2007). Пироксикам показал свою эффективность у собак с ПКР, особенно при комбинации его с цисплатином или карбоплатином (Schmidt BR et al. 2001; Boria PA et al. 2004; de Vow JP et al. 2005). Липосомы с инкапсулированным цисплатином не показали свою эффективность у кошек с ПКР, однако митоксантрон в комбинации с лучевой терапией показал свою некоторую эффективность с хорошим локальным ответом и длительной ремиссией (Fox LE et al. 2000).
Препараты платины являются наиболее эффективными у собак с меланомой, включая внутриопухолевое введение цисплатина и системное применение карбоплатина (Kitchell BE et al. 2001; Rassnick KM et al. 2001; Page RL et al. 1991).
Иммунотерапия меланом будет рассмотрена в отдельной статье, посвященной меланоме.
Прогноз у животных с опухолями ротовой полости
Результаты лечения различных опухолей ротовой полости методом максиллэктомии и мандибулэктомии у собак представлены в таблицах ниже (Kirpensteijn J et al. 1994; Lascelles BDX et al. 2004; Fox LE et al. 1997; Hayes AM et al. 2007; Bregazzi VS et al. 2001; Nagata K et al. 2011; Hilmas DE et al. 1976; Creasey WE et al. 1982; Heyman SJ et al. 1992; Hammer AS et al. 1995; Straw RC et al. 1996).
| Вид опухоли | Число животных | Локальные рецидивы (%) | Медиана продолжительности жизни (мес.) | Годичная выживаемость (%) |
|---|---|---|---|---|
| Злокачественная меланома | 81 | 0-40 | 7-17 | 21 |
| Плоскоклеточный рак | 74 | 0-23 | 9-26 | 80-91 |
| Фибросаркома | 58 | 31-60 | 11-12 | 23-50 |
| Остеосаркома | 144 | 15-44 | 6-18 | 35-71 |
| Амелобластома | 116 | 0-3 | Более 28-64 | 98-100 |
| Вид опухоли | Число животных | Локальные рецидивы (%) | Медиана продолжительности жизни (мес.) | Годичная выживаемость (%) |
|---|---|---|---|---|
| Злокачественная меланома | 37 | 21-48 | 5-10 | 27 |
| Плоскоклеточный рак | 13 | 29-50 | 19 | 57 |
| Фибросаркома | 33 | 33-57 | 10-12 | 21-50 |
| Остеосаркома | 50 | 27-100 | 4-10 | 17-27 |
| Амелобластома | 30 | 0-11 | Более 26-30 | 72-100 |
Наименьшее число локальных рецидивов и наибольшая продолжительность жизни наблюдается при хирургическом лечении амелобластомы и плоскоклеточного рака, более худшие результаты наблюдаются при лечении фибросаркомы и злокачественной меланомы. Наиболее благоприятными прогностическими факторами являются: «чистые» границы резекции, небольшой размер новообразования и ростральное расположение опухоли.
Эффективность лучевой терапии у собак во многом зависит от вида опухоли и ее размера. Наиболее чувствительными опухоли у собак являются амелобластома и плоскоклеточный рак. Рецидивы могут отмечаться в >30% случаев, однако это во много зависит от размера первичной опухоли.
Злокачественная меланома ротовой полости
Прогноз для собак со злокачественной меланомой является осторожным. Появление отдаленных метастазов является основной причиной смерти пациентов (14-67% случаев). Хирургическая операция и лучевая терапия являются хорошим средством местного контроля за опухолью, однако для борьбы с метастазами необходимо применять химио- и иммунотерапию.
Хирургическая операция является самым основным способом локального лечения опухоли. Рецидивы могут наблюдаться в 22% при проведении мандибулэктомии и 48% — максиллэктомии. Медиана продолжительности жизни только при хирургическом лечении составляет 150-318 суток (без лечения 65 суток), а 1 годичная выживаемость не превышает 35%. Стадия опухолевого процесса значительно влияет на прогноз, так при диаметре опухоли менее 2 см медиана продолжительности жизни составляет 511 суток, по сравнению с медианой в 164 дня у животных с опухолями более 2 см в диаметре или метастатическим поражением лимфоузлов.
Злокачественная меланома чувствительна к гипофракционным протоколам облучения. Ответ на терапию наблюдается в 83-100% случаев, а полная ремиссия наблюдается <70% случаев. Локальные рецидивы отмечаются у 15-26% собак после полной ремиссии опухоли, а медиана безрецидивного периода составляет 139 суток. Прогрессирование опухоли наблюдается у всех животных с частичным ответом на облучение. Основная причина гибели животных — появление отдаленных метастазов, которые отмечаются у 58% собак, а медиана метастазирования составляет 311 суток. Медиана продолжительности жизни у собак со злокачественной меланомой на которую воздействовали облучением, составляет 211-363 суток, больше 1 года живут 36-48% животных, а более 2 лет — 21% собак.
Наилучшие результаты отмечаются у животных с рострально расположенными опухолями небольшого размера, без признаков поражения костной ткани или при облучении после хирургической резекции новообразования. Плохими прогностическими факторами являются: аборальное расположение опухоли, лизис костной ткани и большой объем опухоли (по данным одного исследования медиана продолжительности жизни (МПЖ) у собак со злокачественной меланомой составила 21 месяце, если отсутствовали плохие прогностические факторы, 11 месяцев, если присутствовал 1 неблагоприятный фактор, 5 месяцев — 2 и 3 месяца — все три фактора. Размер опухоли тоже важный прогностический фактор, так МПЖ у животных с T1 составляет 19 месяцев, а с T2 и T3 — менее 7 месяцев. Гипофракционное облучение также применяли кошкам с меланомами ротовой полости, ответ наблюдался в 60% случаев, а МПЖ составила 146 суток.
Химиотерапия и иммунотерапия показана как адъювантное лечение злокачественной меланомы у собак из-за высокого риска метастазирования. Более подробно это обсуждается в отдельной статье посвященной меланоме.
Расположение злокачественной меланомы, также имеет свое влияние на прогноз. Так меланомы расположенные в области губы или языка имеют более низкую тенденцию к метастазированию. По данным одного исследования МПЖ для собак с меланомами расположенными в области губ составила 580 суток, языка — 551 сутки, верхней челюсти — 319 суток, твердого неба — 330 суток.
В другом исследовании только 5% собак с высокодифференцированной меланомой слизистой губы или ротовой полости погибло от связанных с опухолью причин, а МПЖ составила 34 месяца. Такие результаты лечения могут быть связаны с местом расположения опухоли или степенью ее дифференциации. Ядерная атипия и митотический индекс также являются важными прогностическими факторами (Spangler WL, Kass PH, 2006).
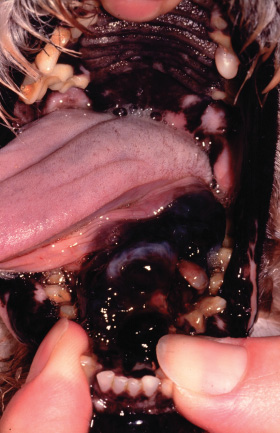
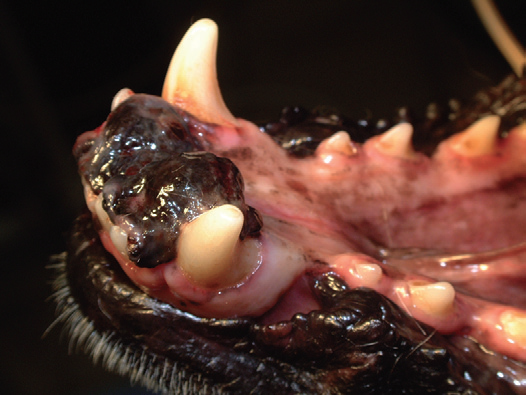
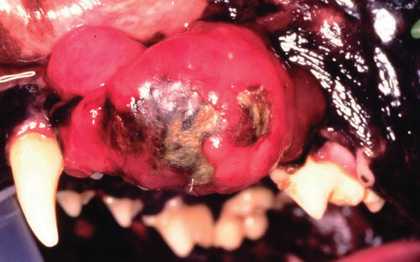
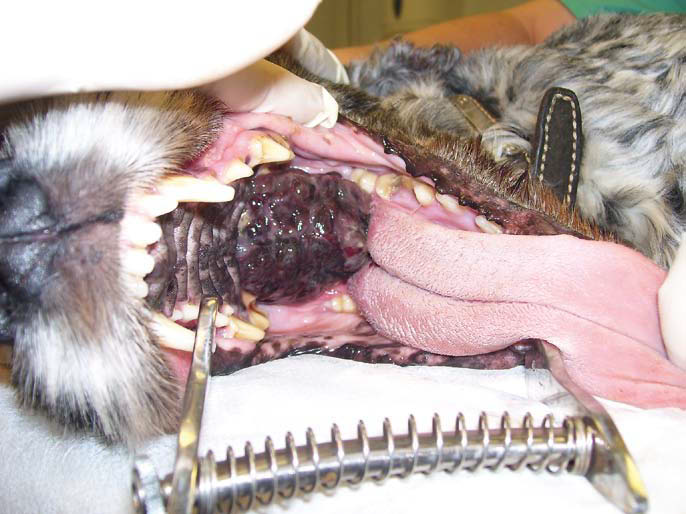
Фото 21. Злокачественная меланома ротовой полости у собак.
Плоскоклеточный рак ротовой полости
Собаки
Прогноз у собак с плоскоклеточным раком ротовой полости в целом от осторожного до хорошего, особенно при ростральном расположении опухоли. Основной задачей является локальный контроль за опухолью, так как метастазирование в регионарные лимфатические узлы отмечается примерно в 10% случаев, в легкие — 3-36% случаев. Если ПКР распологается в области миндалин или корня языка, то рецидивы и метастазирование отмечаются в более чем 73% случаев. Хирургия и лучевая терапия могут быть использованы для локального воздействия на опухоль у собак.
Хирургическая операция самый распространенный способ лечения ПКР ротовой полости у животных. Поле мандибулэктомии рецидивы отмечаются примерно в 10% случаев, МПЖ составляет 19-26 месяцев, а 1 годичная выживаемость составляет 91%. После максиллэктомии рецидивы отмечаются в 29% случаев, МПЖ составляет 10-19 месяцев, а годичная выживаемость составляет 57%.
Применение лучевой терапии в монорежиме или в комбинации с хирургией, является тоже эффективным методом лечения ПКР ротовой полости у собак. Рецидивы отмечаются в 31% случаев. МПЖ при лучевой терапии в монорежиме составляет 15-16 месяцев, а при комбинировании с хирургической операцией 34 месяца. Контроль за опухолью в T1 стадии (до 2 см) превышает 68 месяцев, T2 стадии (2-4 см) — 28 месяцев, а T3 стадии (более 4 см) — 8 месяцев.
Химиотерапия показана собака с метастатическим поражением или если нет возможности провести операцию или лучевую терапию. В целом метастатический потенциал у ПКР ротовой полости считается низким и ценность применения химиотерапии является спорной. В одном исследовании при применении пироксикама у собак с ПКР ротовой полости ответ наблюдался в 17%. Медиана безпрогрессивного периода составила 180 суток. Результаты лучше если пироксикам сочетать с цисплатином или карбоплатином , МПЖ составляет 237 суток (без лечения 116 суток). Однако токсическое поражение почек, при использовании препаратов из группы платины отмечалось в 41% случаев. В одном небольшом исследовании применения пироксикама и карбоплатина у собак с T3 стадией опухолевого процесса, полная ремиссия отмечалась в 57% случаев (Boria PA et al. 2004; Reed SD et al. 2010; MacMillan R et al. 1982; Evans SM, Shofer F, 1988; LaDue-Miller T et al. 1996; Bostock DE, 1972).
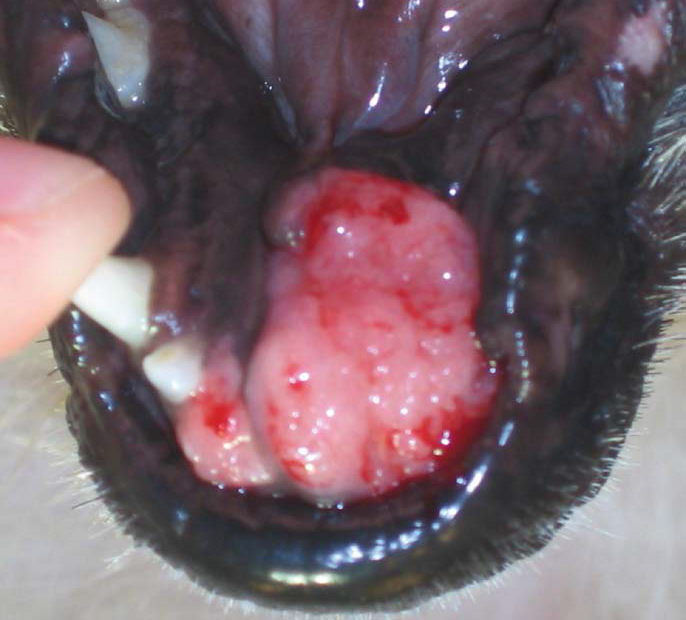
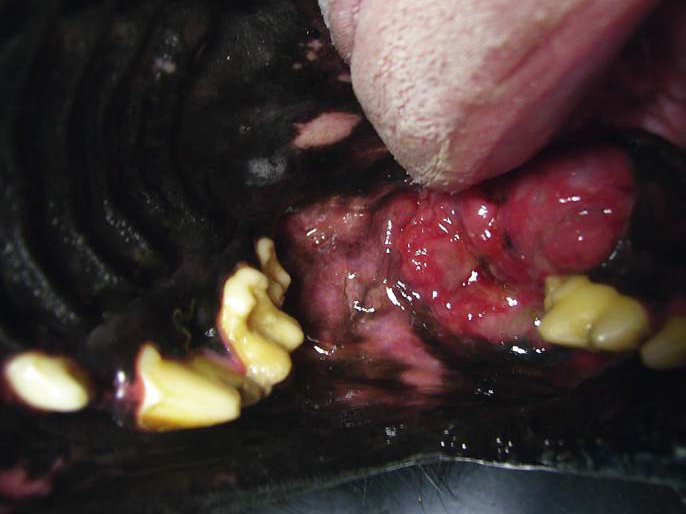
Фото 22. Плоскоклеточный рак ротовой полости у собак.
Кошки
Прогноз для кошек с плоскоклеточным раком ротовой полости остается осторожным/неблагоприятным (Bostock DE, 1972; Cotter SM, 1981). Отсутствует надежным метод лечения, который бы обеспечивал значимую продолжительность жизни и локальный контроль за опухолью. Самой большой трудностью остается локальный контроль за опухолью.
Результаты лечения плоскоклеточного рака в области нижней челюсти являются более оптимистичными по сравнению с ПКР других локализация (язык, верхняя челюсть, миндалины, глотка). Так сочетание хирургии и лучевой терапии позволяет добиться МПЖ в 14 месяцев и 1 годичной выживаемости 57% (Hayes AM et al. 2007). Основной причиной гибели животных является локальный рецидив опухоли, который наблюдался в 86% случаев через 3-36 месяцев после лечения. В другом исследовании лечения ПКР в области нижней челюсти, МПЖ составила 340 суток при выполнении различных видов мандибулэктомий. В послеоперационном периоде может потребоваться установка эзофагостомы или гастростомы, так как затрудненный прием пищи может наблюдаться в течение нескольких дней или месяцев после операции.
Лучевая терапия в монорежиме считается малоэффективным методом лечения ПКР у кошек. В одной статье применялся протокол, состоящий из 14 фракций по 3,5 Гр (по 2 фракции в течение 9 суток), общая продолжительность жизни составила 86 суток (у кошек с полной ремиссией опухоли — 298 суток). Сочетание облучения и химиотерапии позволяет улучшить результаты лечения. Так в одной статье лучевую терапию сочетали с введением карбоплатина и получили МПЖ в 163 дня (Field J et al. 2011). Внутриопухолевое введение этанидазола позволило получить 100% ответ на облучение, среднее уменьшение опухолевой массы составило 76%, а МПЖ — 116 суток (Evans SM et al. 1991). Сочетание лучевой терапии и митоксантрона позволило получить полную ремиссию заболевания у 73% кошек и МПЖ в 184 дня (Ogilvie GK et al. 1993).
Химиотерапия считается малоэффективной у кошек с ПКР ротовой полости. В ряде исследований отсутствовал ответ на терапию липосом-инкапсулированный цисплатин или пироксикам. Есть статьи о некоторой эффективности нестероидных противовоспалительных средств у кошек с плоскоклеточным раком ротовой полости (Hayes AM et al. 2007).
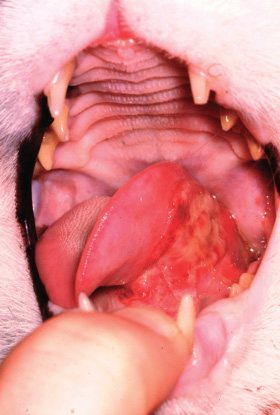
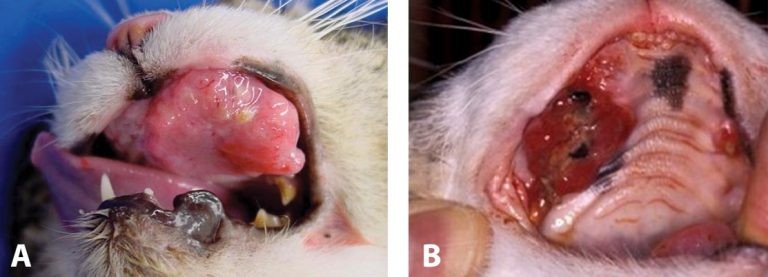
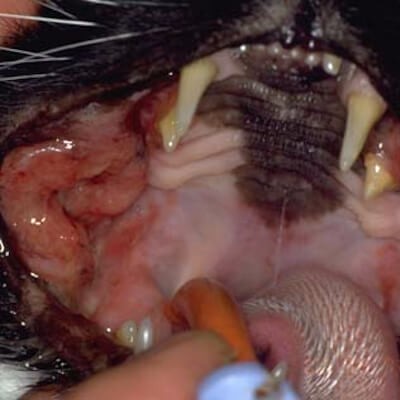
Фото 23. Плоскоклеточный рак ротовой полости у кошек.
Фибросаркома
Прогноз для собак с фибросаркомой в ротовой полости является осторожным. Это место деструктивная опухоль и локальный контроль за новообразованием остается главной проблемой в лечении. Метастазирование в регионарные лимфатические узлы отмечается в 19-22% случаев, легкие — 27% случаев. Мультимодальный подход к лечению, который сочетает в себе хирургическую операцию и лучевую терапию, является самым эффективным методом лечения.
Хирургическая операция является самым распространенным способом лечения фибросаркомы. МБП у кошек после мандибулэктомии составляет 859 суток. После мандибулэктомии, локальные рецидивы встречаются в 59% случаев у собак, МПЖ составляет 11 месяцев, а 1 годичная выживаемость — 50%. Сочетание оперативного лечения и лучевой терапии повышает эффективность лечения.
Фибросаркомы ротовой полости относительно резистентны к облучению (Hilmas DE, Gillette EL, 1976; Creasey WA et al. 1982). Медиана продолжительности жизни у собак с фибросаркомами при облучении составляет всего 7 месяцев. Когда лучевую терапию комбинируют с оперативным лечением, МПЖ возрастает с 18 до 26 месяцев, а 1 годичная выживаемость составляет 76%.
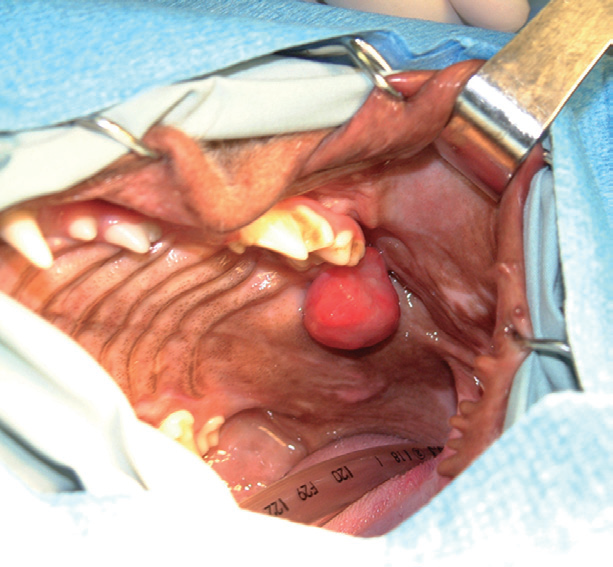
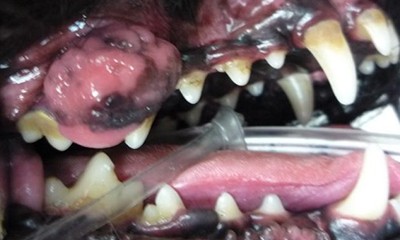
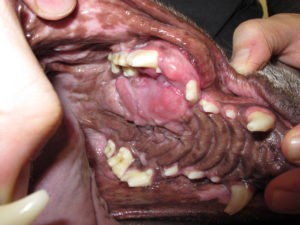
Фото 24. Фибросаркома ротовой полости у собак.
Остеосаркома
Остеосаркома костей осевого скелета встречается реже чем костей конечностей и составляет примерно 25% от всех случаев (Heyman SJ et al. 1992). Остеосаркома осевого скелета в 27% локализуется в в области нижней челюсти и 16-22% — верхней челюсти (Hammer AS et al. 1995). Прогноз для остеосаркомы верхней или нижней челюсти лучше чем для периферического скелета из-за более низкого метастатического потенциала.
Результаты лечения остеосаркомы методом мандибулэктомии позволяют добиться МПЖ в 14-18 месяцев, с 1 годичной выживаемостью 35-71% (Straw RC et al. 1996). Основные причины гибели: локальный рецидив опухоли (15%) и метастатическое поражение отдаленных органов (35%). Результаты после максиллэктомии: медиана продолжительности жизни — 5-10 месяцев, 1 годичная выживаемость — 17-27%, локальные рецидивы опухоли — 83-100%. Основная причина смерти собак с остеосаркомой верхней челюсти — локальный рецидив болезни.
Локальный контроль за опухолью является основной целью лечения («чистые» границы резекции). Так при полной резекции остеосаркомы, медиана продолжительности жизни может достигать 1503 суток, а при неполной резекции опухоли — 199 суток. Сочетание оперативного лечения с облучением/химиотерапией не оказывает значимого влияния на результат. Благоприятными прогностическими факторами являются: «чистые» границы резекции опухоли, локализация в области нижней челюсти и маленькая масса тела животного. Роль химиотерапии у животных с осевой остеосаркомой остается неизвестной (Kazmierski KJ et al. 2002).
Эпулисы
Периферическая одонтогенная фиброма
Прогноз для животных с одонтогенными фибромами является хорошим. Метастазирование данных новообразований не описано и основной целью лечения является хирургическое удаление опухоли. При неполном удалении опухоли возможны ее рецидивы, особенно у кошек с множественным поражением ротовой полости.
Акантоматозная амелобластома
Для лечения амелобластомы можно использовать хирургию и лучевую терапию. Из-за тенденции к инвазии опухоли в кость, часто есть необходимость в проведении частичной максиллэктомии или мандибулэктомии. Рецидивы после таких операций не превышают 5%. Альтернативным вариантом лечения является лучевая терапия (фракции по 4 Гр с общей дозой в 48 Гр). Рецидивы могут отмечаться в 8-18% случаев, особенно если опухоль более 4 см в диаметре. К другим осложнениям лучевой терапии относят малигнизацию опухоли и некроз костной ткани. Описано лечение амелобластомы внутриопухолевым введением блеомицина у 4 собак, полная ремиссия отмечалась у всех животных (в течение года рецидивов отмечено не было)(Yoshida K et al. 1998).
Добавочный материал
Тонзиллярный плоскоклеточный рак
Тонзиллярный ПКР встречается в 10 раз чаще у животных живущих в городской среде, что вероятно связано с влиянием окружающей среды (Reif JS, Cohen D, 1971). Первичным раком миндалин чаще всего является плоскоклеточная карцинома. Лимфома также может поражать миндалины, но в основном в виде системной формы с лимфаденопатией. Другой описанной опухолью является злокачественная меланома ротовой полости, которая может давать метастазы в миндалины. Увеличение шейных лимфоузлов частая находка у животных даже с небольшими поражениями миндалин. Тонкоигольная аспирационная биопсия лимфоузлов или инцизионная биопсия миндалин позволяет поставить окончательный диагноз. Рентгенография органов грудной клетки выявляет метастазы примерно в 10-20% случаев. Несмотря на локальное поражение миндалин в 90% случаев у собак и кошек в момент постановки диагноза болезнь уже имеет системный характер. Обычная тонзиллэктомия практически никогда не позволяет вылечить животное (рекомендовано как минимум удалять миндалины с двух сторон). Метастатическое поражение лимфоузлов является признаком неизлечимости болезни. Локальное облучение миндалин и шейных лимфоузлов позволяет получить ответ на лечение в 75%, но редко 1 годичная выживаемость превышает 10% от всех случаев. Результаты лучевой терапии можно улучшить если сочетать ее с различными протоколами химиотерапии (цисплатин, карбоплатин, доксорубицин, винбластин и блеомицин). Основные причины смерти это локальное прогрессирование болезни или метастатическое поражение легких. В одном исследовании тонзиллярный плоскоклеточный рак лечили при помощи хирургии, облучения и химиотерапии — медиана продолжительности жизни составила 179 суток (Mas A et al. 2011).
Новообразования языка
В целом опухоли языка встречаются достаточно редко. По данным одного исследования 54% поражений языка являются неопластическими, 64% из которых — злокачественные опухоли (Dennis MM et al. 2006). Породная предрасположенность: чау-чау и шарпеи к злокачественной меланоме; пудели и лабрадоры ретриверы и самоеды к плоскоклеточному раку; бордер-колли и золотистые ретриверы к гемангиосаркоме и фибросаркоме; кокер-спаниели к плазмоцитарным новообразованиям. Самым распространенным новообразованием языка у собак является плоскоклеточный рак (50% от всех случаев), далее следуют гранулярно-клеточная миобластома, злокачественная меланома, мастоцитома, фибросаркома, аденокарцинома, нейрофибросаркома, лейомиосаркома, гемангиосаркома, гемангиома, рабдомиома, рабдомиосаркома, миксома и липома (Carpenter LG et al. 1993; Brodey RS, 1960). У кошек в основном диагностируют плоскоклеточный рак, расположенный чаще всего в области корня языка или на его вентральной поверхности. Клинические симптомы в целом схожи с другими новообразованиями ротовой полости.
Под общей анестезией можно провести инцизионную биопсию (часто требуется наложение нескольких швов для остановки кровотечения). Биопсию необходимо провести для дифференциации новообразований от неопухолевых поражений, таких как эозинофильная гранулема, воспаление и кальциноз circumscripta. У животных с опухолями языка необходимо провести тонкоигольную биопсию регионарных лимфатических узлов и рентгенографию органов грудной клетки для определения стадии заболевания.
Основной способ лечения — хирургическая резекция новообразования, лучевую терапию можно использовать у животных со злокачественной меланомой, неоперабельным раком или метастатическим поражением лимфоузлов. В целом, по данным ряда исследований, резекция от 50 до 100% тканей языка хорошо переносится животными с минимальным снижением качества жизни (Dvorak LD et al. 2004). Однако в послеоперационном периоде животному потребуется установка стомы для обеспечения энтерального питания и сроки адаптации к жизни после операции значительно варьируются. В долгосрочной перспективе большинство животных адаптируются к самостоятельному потреблению воды и пищи. Основной проблемой после таких операций является гиперсаливация. Терморегуляция может стать проблемой у животных проживающих в жарких климатических условиях. Нарушение груминга у кошек может стать причиной плохого состояния шерсти.
Прогноз для опухолей языка зависит от места расположения, типа и стадии опухолевого процесса. Степень злокачественности плоскоклеточного рака у собак подразделяется на I-III градации, в зависимости от степени дифференциации и кератинизации, митотическом индексе, сосудистой и тканевой инвазии, а также ядерного плеоморфизма. Медиана продолжительности жизни у собак с I степенью злокачественности плоскоклеточного рака составляет 16 месяцев после хирургической резекции опухоли, а II и III степенью — 4 и 3 месяца соответственно. Длительный контроль у кошек с ПКР редко достижим и 1 годичная выживаемость составляет менее 25%.
Гранулярно-клеточная миобластома является излечиваемым заболеванием (Turk MM et al. 1983). Эти опухоли могут выглядеть объемными и инвазивными, однако хорошо поддаются хирургическому удалению с минимальными границами резекции. Локальный контроль за опухолью достигает 80%, рецидивы могут встречаться однако возможно проведение повторной резекции. Метастазирование отмечается редко.
Для остальных новообразований биологическое поведение в целом схожее с другими локализациями.
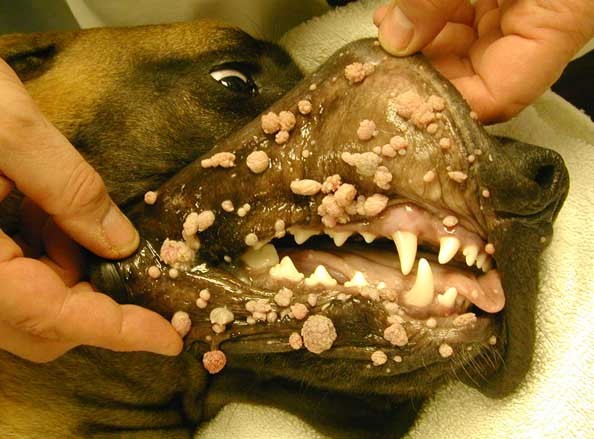
Недифференцированные опухоли у молодых собак
Недифференцированные опухоли могут встречаться у собак до 2 летнего возраста (6-22 месяца)(Patnaik AK et al. 1986). В большинстве случаев опухоли встречаются у собак крупных пород. Опухоли характеризуются в виде быстрорастущей массы в области твердого неба, верхних моляров и костях максиллы или орбиты. Биопсия часто выявляет недифференцированную опухоль неизвестного генеза. Часто отмечаются метастазы в регионарных лимфатических узлах и тканях в области головы/шеи. Эффективного лечения не существует, химиотерапию можно рассматривать как метод лечения из-за высокой тенденции опухоли к метастазированию. В большинстве случаев животное эвтаназируют в течение 30 суток после постановки диагноза из-за прогрессирования болезни.
Папиллярный плоскоклеточный рак может встречаться в ротовой полости у молодых собак (2-5 месяцев). Лечением является хирургическая резекция опухоли или ее криодеструкция с последующим облучением. Такая лечебная тактика позволяет получить надежный контроль за опухолью и длительную продолжительность жизни (от 4 и более лет)(Ogilvie GK et al. 1988).
Мультилобарная остеохондросаркома
Мультилобарная остеохондросаркома это редкая костно-хрящевая опухоль у собак, которая развивается из костей черепа (верхняя/нижняя челюсть, орбита, твердое небо и другие). Гистологически данная опухоль характеризуется множественными полостями с центральным хрящевым или костным матриксом, окруженным тонким слоем веретенообразных клеток. На КТ данная опухоль имеет характерное строение похожее на «зерна попкорна». Рекомендованным методом лечения является хирургическая резекция опухоли. Частота рецидивирования составляет 47-58% и зависит от «чистоты» границ резекции и гистологической степени злокачественности. МБП при полном удалении опухоли достигает 1332 дня, а при неполном удалении всего 330 суток. Локальный рецидив отмечается чаще при высокозлокачественной остеохондросаркоме и достигает 78%, что значительно меньше для средне- и низкозлокачественных опухолей (47% и 30% соответственно). Опухоль обладает средним потенциалом к метастазированию, которое также зависит от степени злокачественности (метастазирование в 78%, 60% и 30% у высоко-, средне- и низкозлокачественных опухолей соответственно) и может достигать 58% случаев с медианой метастазирования в 426-542 дня. Метастазирование гораздо более вероятно при неполном удалении опухоли (75% при неполном удалении и 25% при полном). Общая медиана продолжительности жизни составляет 21 месяц (50, 22 и 11 месяцев для низко-, средне- и высокозлокачественных опухолей соответственно). Локализация опухоли также влияет на прогноз, который наиболее благоприятный при поражении нижней челюсти (1487 суток), по сравнению с другими местами локализации новообразования (587 суток). Роль и эффективность химиотерапии до конца не изучена.
Вирусный папилломатоз
Вирусный папилломатоз это заболевание которое взывает вирусный агент (паповавирус), передающийся от собаке к собаке. Заболевшие животные обычно молодого возраста. Клиническая картина характеризуется наличием множественных «бородавок» в области слизистой ротовой полости, языка, губ и глотки. Биопсию проводят при необходимости, однако обычно для постановки диагноза увидеть типичную клиническую картину. В большинстве случаев заболевания не мешает животному, однако в некоторых случаях они могут мешать нормальному приему пищи, что может потребовать их хирургическое удаление или криодеструкцию. Заболевания обычно самостоятельно проходит через 4-8 недель. В резистентных случаях, как правило, связанных с иммуносупрессивным состоянием животного применяют различные способы лечения: аутогенные вакцины, интерлейкины, левамизол, тиабендазол, имиквимод и другие лекарства (Calvert CA, 1984). Однако эффективность этих методов лечения остается спорной.
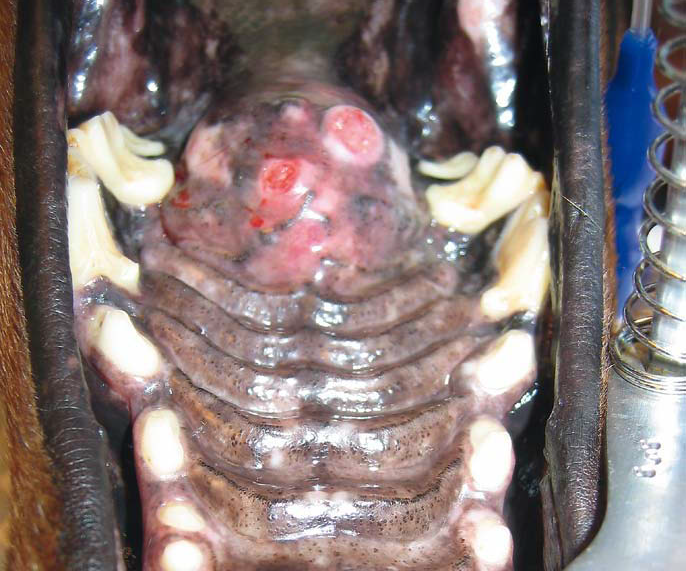
Одонтогенные опухоли
Одонтогенные опухоли развиваются из эпителиальных клеток зубного ложа и составляю 2.4% от всех новообразований ротовой полости у кошек. К индуктивным одонтогенным опухолям относят: амелобластная фиброма, дентинома и различные одонтомы. К неиндуктивным: амелобластомы и кальцифицирующие эпителиальные одонтогенные опухоли (Poulet FM et al. 1992).
Индуктивная фиброамелобластома самая частая одонтогенная опухоль у кошек, которая встречается обычно в возрасте до 18 месяцев и распологается в области клыков и верхней челюсти (Dubielzig RR et al. 1994; Dernell WS, Hullinger GH, 1994). Рентгенографически опухоль характеризуется различной степенью разрушения/продукции костной ткани верхней или нижней челюсти. Часто наблюдается деформация зубов. Небольшие поражения лечат путем криохирургии или сегментарной резекцией кости. Объемные поражения можно лечить при помощи лучевой терапии. Может потребоваться агрессивная локальная резекция опухоли, однако прогноз для опухоли остается хорошим, отдаленное метастазирование не описано.
Одонтомы это доброкачественные опухоли, которые развиваются из зубного фолликула в процессе формирования зуба. Биологическое поведение схожее с амелобластомой.
Зубные кисты это не опухолевые поражения, которые содержат внутри своей полости один или несколько зубов и могут является предшествинниками злокачественных одонтогенных новообразований. Лечение заключается в иссечении кисты и замещением дефекта аутокостью, для предотвращения ее рецидивирования.
Эозинофильные гранулемы
Собаки
Эозинофильные гранулемы встречаются у молодых собак (1-7 лет). Породная предрасположенность отмечена у сибирских хасок и кавалер кинг чарльз спаниелей (Potter KA et al. 1980; Madewell BR et al. 1980; Bredal WP et al. 1996). Гранулемы обычно развиваются на латеральной или вентральной стороне языка. Клиническая картина может быть схожей со злокачественной опухолью. Лечение включает в себя применение глюкокортикостероидов или хирургическое иссечение. Возможны спонтанные регрессии гранулемы. Рецидивы встречаются редко.
Кошки
Эозинофильные гранулемы чаще всего встречаются у самок кошек среднего возраста (5 лет) (Scott DW, 1980; McClelland RB, 1954; MacEwen EG, Hess PW, 1987; Song MD. 1994). Этиология не известна. Самое частое место локализации гранулемы это область верхней губы. Биопсия необходима для постановки диагноза.
Описаны различные способы лечения: преднизолоном (1-2 мг/кг/12 часов в течение 30 суток), метилпреднизолоном ацетатом (20 мг/кошка каждые 2 недели), мегестролом ацетатом, гипоаллергенной диетой, облучением, хирургическим удалением и криохирургией. Прогноз осторожный. Возможны спонтанные регрессии гранулемы.
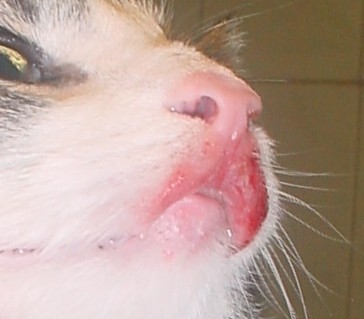
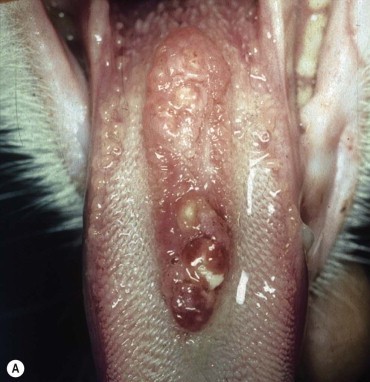
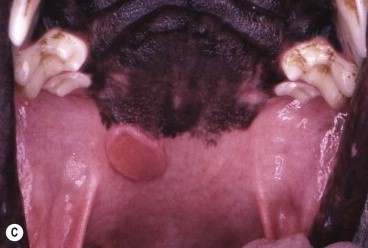
Фото 31. Эозинофильная гранулема у кошек.
Назофарингеальные полипы у кошек
Полипы представляют собой неопухолевые воспалительные массы, которые берут свое начало из среднего уха или евстахиевой трубы. Полипы могут прорастать в область наружного слухового канала или носоглотки (Kapatkin AS et al. 1990; Kudin ST, 2002). Чаще всего заболевают молодые кошки (медиана 13.6 месяцев)(Bradley RL et al. 1985). Точная причина возникновения неизвестна, но предполагают вирусную теорию и нарушение развития жаберных дуг. Клиническая картина: чихание, изменение голоса, дисфагия, ринит и затрудненное дыхание. Полип можно обнаружить в области глотки или наружном слуховом канале. Рентгенография, КТ или МРТ помогают более точно определить расположение полипа. Стартовое лечение включает в себя тракцию и авульсию полипа. При рецидивах возможно проведение остеотомии барабанного пузыря (рецидивы отмечаются менее чем в 4%)(Harvey CE, Goldschmidt MH, 1978; Faulkner JE, Budsberg SC, 1990; Parker NR, Binnington AG, 1985; Trevor PB, Martin RA, 1993).
Сравнительные аспекты
Плоскоклеточный рак является самой распространенной опухолью ротовой полости у людей. Предрасполагающими факторами является прием алкоголя и курение табака. Заболевают обычно люди старше 40 летнего возраста. Плоскоклеточный рак ротовой полости может способствовать появлению рака пищевода или легких. Стадирование и прогноз опухоли схожий с таковым у животных (Mendenhall WM et al. 2005).
Хирургия и лучевая терапия являются основными способами лечения, которые часто комбинируют, что позволяет добиться излечиваемости заболевания в более чем 70% случаев. Химиотерапию обычно используют при продвинутой стадии заболевания.
Прогноз во многом зависит от стадии заболевания, гистологической градации и места локализации опухоли. Метастазирование в регионарные лимфатические узлы встречается более часто при тонзиллярном или глоточном расположении опухоли.
Литература
- Hoyt RF, Withrow SJ: Oral malignancy in the dog, J Am Anim Hosp Assoc 20:83, 1984.
- Bronden LB, Eriksen T, Kristensen AT: Oral malignant melanomas and other head and neck neoplasms in Danish dogs: data from the Danish Veterinary Cancer Registry, Acta Vet Scand 51:54, 2009.
- Stebbins KE, Morse CC, Goldschmidt MH: Feline oral neoplasia: a ten year survey, Vet Pathol 26:121, 1989.
- Dorn CR, Taylor DON, Frye FL, et al: Survey of animal neoplasms in Alameda and Contra Costa Counties, California. I. Methodology and description of cases, J Natl Cancer Inst 40:295, 1968.
- Dorn CR, Taylor DON, Schneider R, et al: Survey of animal neoplasms in Alameda and Contra Costa Counties, California. II. Cancer morbidity in dogs and cats from Alameda County, J Natl Cancer Inst 40:307, 1968.
- Cohen D, Brodey RS, Chen SM: Epidemiologic aspects of oral and pharyngeal neoplasms in the dog, Am J Vet Res 25:1776, 1964.
- Kudnig ST, Ehrhart N, Withrow SJ, et al: Survival analysis of oral melanoma in dogs, Vet Cancer Soc Proc 23:39, 2003.
- Dorn CR, Priester WA: Epidemiologic analysis of oral and pharyngeal cancer in dogs, cats, horses and cattle, J Am Vet Med Assoc 169:1202, 1976.
- Ramos-Vara JA, Beissenherz ME, Miller MA, et al: Retrospective study of 338 canine oral melanomas with clinical, histologic, and immunohistochemical review of 129 cases, Vet Pathol 37:597, 2000.
- Todoroff RJ, Brodey RS: Oral and pharyngeal neoplasia in the dog: a retrospective survey of 361 cases, J Am Vet Med Assoc 175:567, 1979.
- Withrow SJ, Holmberg DL: Mandibulectomy in the treatment of oral cancer, J Am Anim Hosp Assoc 19:273, 1983.
- Withrow SJ, Nelson AW, Manley PA, et al: Premaxillectomy in the dog, J Am Anim Hosp Assoc 21:49, 1985.
- White RAS, Gorman NT, Watkins SB, et al: The surgical management of bone-involved oral tumours in the dog, J Small Anim Pract 26:693, 1985.
- Bradley RL, MacEwen EG, Loar AS: Mandibular resection for removal of oral tumors in 30 dogs and 6 cats, J Am Vet Med Assoc 184:460, 1984.
- Salisbury SK, Richardson DC, Lantz GC: Partial maxillectomy and premaxillectomy in the treatment of oral neoplasia in the dog and cat, Vet Surg 15:16, 1986.
- Salisbury SK, Lantz GC: Long-term results of partial mandibulectomy for treatment of oral tumors in 30 dogs, J Am Anim Hosp Assoc 24:285, 1988.
- White RAS: Mandibulectomy and maxillectomy in the dog: long-term survival in 100 cases, J Small Anim Pract 32:69, 1991.
- Kosovsky JK, Matthiesen DT, Marretta SM, et al: Results of partial mandibulectomy for the treatment of oral tumors in 142 dogs, Vet Surg 20:397, 1991.
- Wallace J, Matthiesen DT, Patnaik AK: Hemimaxillectomy for the treatment of oral tumors in 69 dogs, Vet Surg 21:337, 1992.
- Schwarz PD, Withrow SJ, Curtis CR, et al: Mandibular resection as a treatment for oral cancer in 81 dogs, J Am Anim Hosp Assoc 27:601, 1991.
- Schwarz PD, Withrow SJ, Curtis CR, et al: Partial maxillary resection as a treatment for oral cancer in 61 dogs, J Am Anim Hosp Assoc 27:617, 1991.
- Richardson RC: Canine transmissible venereal tumor, Compend Contin Educ Pract Vet 3:951, 1981.
- Straw RC, LeCouteur RA, Powers BE, et al: Multilobular osteochondrosarcoma of the canine skull: 16 cases (1978-1988), J Am Vet Med Assoc 195:1764, 1989.
- Dernell WS, Straw RC, Cooper MF, et al: Multilobular osteochondrosarcoma in 39 dogs: 1979-1993, J Am Anim Hosp Assoc 34:11, 1998.
- Farrelly J, Denman DL, Hohenhaus AE, et al: Hypofractionated radiation therapy of oral melanoma in five cats, Vet Radiol Ultrasound 45:91, 2004.
- Overley B, Goldschmidt M, Shofer F, et al: Canine oral melanoma: a retrospective study, Vet Cancer Soc Proc 21:43, 2001.
- William LE, Packer RA: Association between lymph node size and metastasis in dogs with oral malignant melanoma: 100 cases (1987-2001), J Am Vet Med Assoc 222:1234, 2003.
- Freeman KP, Hahn KA, Harris FD, et al: Treatment of dogs with oral melanoma by hypofractionated radiation therapy and platinumbased chemotherapy (1987-1997), J Vet Intern Med 17:96, 2003.
- Brewer WG, Turrel JM: Radiotherapy and hyperthermia in the treatment of fibrosarcomas in the dog, J Am Vet Med Assoc 181:146, 1982.
- Bateman KE, Catton PA, Pennock PW, et al: Radiation therapy for the treatment of canine oral melanoma, J Vet Intern Med 8:267, 1994.
- Blackwood L, Dobson JM: Radiotherapy of oral malignant melanomas in dogs, J Am Vet Med Assoc 209:98, 1996.
- Théon AP, Rodriguez C, Madewell BR: Analysis of prognostic factors and patterns of failure in dogs with malignant oral tumors treated with megavoltage irradiation, J Am Vet Med Assoc 210:778, 1997.
- MacEwen EG, Patnaik AK, Harvey HJ, et al: Canine oral melanoma: comparison of surgery versus surgery plus Corynebacterium parvum, Cancer Invest 4:397, 1986.
- MacEwen EG, Kurzman ID, Vail DM, et al: Adjuvant therapy for melanoma in dogs: results of randomized clinical trials using surgery, liposome-encapsulated muramyl tripeptide and granulocyte-macrophage colony stimulating factor, Clin Cancer Res 5:4249, 1999.
- Harvey HJ, MacEwen GE, Braun D, et al: Prognostic criteria for dogs with oral melanoma, J Am Vet Med Assoc 178:580, 1981.
- Owen LN: TNM classification of tumors in domestic animals, Geneva, 1980, WHO.
- Proulx DR, Ruslander DM, Dodge RK, et al: A retrospective analysis of 140 dogs with oral melanoma treated with external beam radiation, Vet Radiol Ultrasound 44:352, 2003.
- Hahn KA, DeNicola DB, Richardson RC, et al: Canine oral malignant melanoma: prognostic utility of an alternative staging system, J Small Anim Pract 35:251, 1994.
- Moore AS, Theilen GH, Newell AD, et al: Preclinical study of sequential tumor necrosis factor and interleukin 2 in the treatment of spontaneous canine neoplasms, Cancer Res 51:233, 1991.
- Elmslie RE, Dow SW, Potter TA: Genetic immunotherapy of canine oral melanoma, Vet Cancer Soc Proc 14:111, 1994.
- Elmslie RE, Potter TA, Dow SW: Direct DNA injection for the treatment of malignant melanoma, Vet Cancer Soc Proc 15:52, 1995.
- Dow SW, Elmslie RE, Willson AP, et al: In vivo tumor transfection with superantigen plus cytokine genes induces tumor regression and prolongs survival in dogs with malignant melanoma, J Clin Invest 101:2406, 1998.
- Hogge G, Burkholder J, Culp J, et al: Development of human granulocyte-macrophage colony-stimulating factor-transfected tumor cell vaccines for the treatment of spontaneous cancer, Human Gene Ther 9:1851, 1998.
- Quintin-Colonna F, Devauchelle P, Fradelizi D, et al: Gene therapy of spontaneous canine melanoma and feline fibrosarcoma by intratumoral administration of histoincompatible cells expressing human interleukin-2, Gene Ther 3:1104, 1996.
- Bergman PJ, Camps-Palau MA, McKnight JA, et al: Development of a xenogeneic DNA vaccine program for canine malignant melanoma with prolongation of survival in dogs with locoregionally controlled stage II-III disease, Vet Cancer Soc Proc 23:40, 2003.
- Bergman PJ, McKnight J, Novosad A, et al: Long-term survival of dogs with advanced malignant melanoma after DNA vaccination with xenogeneic human tyrosinase: a phase I trial, Clin Cancer Res 9:1284, 2003.
- Bergman PJ, Camps-Palau MA, McKnight JA, et al: Phase I & IB trials of murine tyrosinase ± human GM-CSF DNA vaccination in dogs with advanced malignant melanoma, Vet Cancer Soc Proc 24:55, 2004.
- Modiano JF, Ritt MG, Wojcieszyn J: The molecular basis of canine melanoma: pathogenesis and trends in diagnosis and therapy, J Vet Intern Med 13:163, 1999.
- Sulaimon SS, Kitchell BE: The basic biology of malignant melanoma: molecular mechanisms of disease progression and comparative aspects, J Vet Intern Med 17:760, 2003.
- Bertone ER, Snyder LA, Moore AS, et al: Environmental and lifestyle risk factors for oral squamous cell carcinoma in domestic cats, J Vet Intern Med 17:557, 2003.
- Snyder LA, Bertone ER, Jakowski RM, et al: p53 expression and environmental tobacco smoke exposure in feline oral squamous cell carcinoma, Vet Pathol 41:209, 2004.
- Martin CK, Tannehill-Gregg SH, Wolfe TD, et al: Bone-invasive oral squamous cell carcinoma in cats: pathology and expression of parathyroid hormone-related protein, Vet Pathol 48:302, 2011.
- Hutson CA, Willauer CC, Walder EJ, et al: Treatment of mandibular squamous cell carcinoma in cats by use of mandibulectomy and radiotherapy: seven cases (1987-1989), J Am Vet Med Assoc 201:777, 1992.
- Ciekot PA, Powers BE, Withrow SJ, et al: Histologically low grade yet biologically high grade fibrosarcomas of the mandible and maxilla of 25 dogs (1982-1991), J Am Vet Med Assoc 204:610, 1994.
- Colgin LMA, Schulman FY, Dubielzig RR: Multiple epulides in 13 cats, Vet Pathol 38:227, 2001.
- Dubielzig RR: Proliferative dental and gingival disease of dogs and cats, J Am Anim Hosp Assoc 18:577, 1982.
- Bjorling DE, Chambers JN, Mahaffey EA: Surgical treatment of epulides in dogs: 25 cases (1974-1984), J Am Vet Med Assoc 190:1315, 1987.
- Yoshida K, Yanai T, Iwasaki T, et al: Clinicopathological study of canine oral epulides, J Vet Med Sci 61:897, 1999.
- Fiani N, Vertstraete FJ, Kass PH, et al: Clinicopathologic characterization of odontogenic tumors and focal fibrous hyperplasia in dogs: 152 cases (1995-2005), J Am Vet Med Assoc 238:495, 2011.
- White RAS, Gorman NT: Wide local excision of acanthomatous epulides in the dog, Vet Surg 18:12, 1989.
- Thrall DE: Orthovoltage radiotherapy of acanthomatous epulides in 39 dogs, J Am Vet Med Assoc 184:826, 1984.
- Reeves NCP, Turrel JM, Withrow SJ: Oral squamous cell carcinoma in the cat, J Am Anim Hosp Assoc 29:438, 1993.
- Madewell BR, Ackerman N, Sesline DH: Invasive carcinoma radiographically mimicking primary bone cancer in the mandibles of two cats, J Am Vet Radiol Soc 27:213, 1976.
- Padgett SL, Tillson DM, Henry CJ, et al: Gingival vascular hamartoma with associated paraneoplastic hyperglycemia in a kitten, J Am Vet Med Assoc 210:914, 1997.
- Dhaliwal RS, Kitchell BE, Marretta SM: Oral tumors in dogs and cats. Part I. Diagnosis and clinical signs, Compend Contin Educ Pract Vet 20:1011, 1998.
- Gendler A, Lewis JR, Reetz JA, et al: Computed tomographic features of oral squamous cell carcinoma in cats: 18 cases (2002- 2008), J Am Vet Med Assoc 236:319, 2010.
- Smith MM: Surgical approach for lymph node staging of oral and maxillofacial neoplasms in dogs, J Am Anim Hosp Assoc 31:514, 1995.
- Herring ES, Smith MM, Robertson JL: Lymph node staging of oral and maxillofacial neoplasms in 31 dogs and cats, J Vet Dent 19:122, 2002.
- Lurie DM, Seguin B, Verstraete FJ, et al: Contrast-assisted ultrasound for sentinel node detection in canine head and neck neoplasia, Invest Radiol 41:415, 2006.
- Kirpensteijn J, Withrow SJ, Straw RC: Combined resection of the nasal planum and premaxilla in three dogs, Vet Surg 23:341, 1994.
- Lascelles BD, Thomson MJ, Dernell WS, et al: Combined dorsolateral and intraoral approach for the resection of tumors of the maxilla in the dog, J Am Anim Hosp Assoc 39:294, 2003.
- Lascelles BDX, Henderson RA, Seguin B, et al: Bilateral rostral maxillectomy and nasal planectomy for large rostral maxillofacial neoplasms in six dogs and one cat, J Am Anim Hosp Assoc 40:137, 2004.
- Fox LE, Geoghegan SL, Davis LH, et al: Owner satisfaction with partial mandibulectomy or maxillectomy for treatment of oral tumors in 27 dogs, J Am Anim Hosp Assoc 33:25, 1997.
- Boudrieau RJ, Tidwell AS, Ullman SL, et al: Correction of mandibular nonunion and malocclusion by plate fixation and autogenous cortical bone grafts in two dogs, J Am Vet Med Assoc 204:774, 1994.
- Boudrieau RJ, Mitchell SL, Seeherman H: Mandibular reconstruction of a partial hemimandibulectomy in a dog with severe malocclusion, Vet Surg 33:119, 2004.
- Bracker KE, Trout NJ: Use of a free cortical ulnar autograft following en bloc resection of a mandibular tumor, J Am Anim Hosp Assoc 36:76, 2000.
- Arzi B, Verstraete FJ: Mandibular rim excision in seven dogs, Vet Surg 39:226, 2010.
- Northrup NC, Selting KA, Rassnick KM, et al: Outcomes of cats with oral tumors treated with mandibulectomy, J Am Anim Hosp Assoc 42:350, 2006.
- Bar-Am Y, Verstraete FJM: Elastic training for the prevention of mandibular drift following mandibulectomy in dogs: 18 cases (2005-2008), Vet Surg 39:574, 2010.
- Théon AP, Rodriguez C, Griffey S, et al: Analysis of prognostic factors and patterns of failure in dogs with periodontal tumors treated with megavoltage irradiation, J Am Vet Med Assoc 210:785, 1997.
- Fidel JL, Sellon RK, Houston RK, et al: A nine-day accelerated radiation protocol for feline squamous cell carcinoma, Vet Radiol Ultrasound 48:482, 2007.
- Forrest LJ, Chun R, Adams WM, et al: Postoperative radiation therapy for canine soft tissue sarcoma, J Vet Intern Med 14:578, 2000.
- Thrall DE: Orthovoltage radiotherapy of oral fibrosarcomas in dogs, J Am Vet Med Assoc 172:159, 1981.
- Evans SM, LaCreta F, Helfand S, et al: Technique, pharmacokinetics, toxicity, and efficacy of intratumoral etanidazole and radiotherapy for treatment of spontaneous feline oral squamous cell carcinoma, Int J Radiat Oncol Biol Phys 20:703, 1991.
- Personal Communication: LaRue SM, Vail DM, Ogilvie GK, et al: Shrinking-field radiation therapy in combination with mitoxantrone chemotherapy for the treatment of oral squamous cell carcinoma in the cat, Vet Cancer Soc Proc 11:99, 1991.
- Ogilvie GK, Moore AS, Obradovich JE, et al: Toxicoses and efficacy associated with administration of mitoxantrone to cats with malignant tumor, J Am Vet Med Assoc 202:1839, 1993.
- Jones PD, de Lorimier LP, Kitchell BE, et al: Gemcitabine as a radiosensitizer for nonresectable feline oral squamous cell carcinoma, J Am Anim Hosp Assoc 39:463, 2003.
- Fidel J, Lyons J, Tripp C, et al: Treatment of oral squamous cell carcinoma with accelerated radiation therapy and concomitant carboplatin in cats, J Vet Intern Med 25:504, 2011.
- LeBlanc AL, LaDue TA, Turrel JM, et al: Unexpected toxicity following use of gemcitabine as a radiosensitizer in head and neck carcinomas: a Veterinary Radiation Therapy Oncology Group pilot study, Vet Radiol Ultrasound 45:466, 2004.
- Turrel JM: Principles of radiation therapy. In Thielen GH, Madewell BR, editors: Veterinary cancer medicine, Philadelphia, 1987, Lea & Febiger.
- Overgaard J, Overgaard M, Hansen PV, et al: Some factors of importance in the radiation treatment of malignant melanoma, Radiother Oncol 5:183, 1986.
- Roberts SM, Lavach SD, Severin GA, et al: Ophthalmic complications following megavoltage irradiation of the nasal and paranasal cavities in dogs, J Am Vet Med Assoc 190:43, 1987.
- Jamieson VE, Davidson MG, Naisse MP, et al: Ocular complications following cobalt 60 radiotherapy of neoplasms in the canine head region, J Am Anim Hosp Assoc 27:51, 1991.
- LaRue SM, Gillette EL: Radiation therapy. In Withrow SJ, MacEwen EG, editors: Small animal clinical oncology, Philadelphia, 2001, Saunders.
- Thrall DE, Goldschmidt MH, Biery DN: Malignant tumor formation at the site of previously irradiated acanthomatous epulides in four dogs, J Am Vet Med Assoc 178:127, 1981.
- Gillette EL, McChesney SL, Dewhirst MW, et al: Response of canine oral carcinomas to heat and radiation, Int J Radiat Oncol Biol Phys 13:1861, 1987.
- Dewhirst MW, Sim DA, Forsyth K, et al: Local control and distant metastases in primary canine malignant melanomas treated with hyperthermia and/or radiotherapy, Int J Hyperthermia 1:219, 1985.
- Hayes A, Scase T, Miller J, et al: COX-1 and COX-2 expression in feline oral squamous cell carcinoma, J Comp Pathol 135:93, 2006.
- DiBernardi L, Dore M, Davis JA, et al: Study of feline oral squamous cell carcinoma: potential target for cyclooxygenase inhibitor treatment, Prostaglandins Leukot Essent Fatty Acids 76:245, 2007.
- Schmidt BR, Glickman NW, DeNicola DB, et al: Evaluation of piroxicam for the treatment of oral squamous cell carcinoma in dogs, J Am Vet Med Assoc 218:1783, 2001.
- Boria PA, Murry DJ, Bennett PF, et al: Evaluation of cisplatin combined with piroxicam for the treatment of oral malignant melanoma and oral squamous cell carcinoma in dogs, J Am Vet Med Assoc 224:388, 2004.
- de Vos JP, Burm AGD, Focker BP, et al: Piroxicam and carboplatin as a combination treatment of canine oral non-tonsillar squamous cell carcinoma: a pilot study and a literature review of a canine model of human head and neck squamous cell carcinoma, Vet Comp Oncol 3:16, 2005.
- Fox LE, Rosenthal RC, King RR, et al: Use of cis-bis-neodecanoatotrans- R,R-1,2-diaminocyclohexane platinum (II), a liposomal cisplatin analogue, in cats with oral squamous cell carcinoma, Am J Vet Res 61:791, 2000.
- Kitchell BE, Brown DM, Luck EE, et al: Intralesional implant for treatment of primary oral malignant melanoma in dogs, J Am Vet Med Assoc 204:229, 1994.
- Rassnick KM, Ruslander DM, Cotter SM, et al: Use of carboplatin for treatment of dogs with malignant melanoma: 27 cases (1989- 2000), J Am Vet Med Assoc 218:1444, 2001.
- Page RL, Thrall DE, Dewhirst MW, et al: Phase I study of melphalan alone and melphalan plus whole body hyperthermia in dogs with malignant melanoma, Int J Hyperthermia 7:559, 1991.
- Reed SD, Fulmer A, Buckholz J, et al: Bleomycin/interleukin-12 electrochemogenetherapy for treating naturally occurring spontaneous neoplasms in dogs, Cancer Gene Ther 17:571, 2010.
- Spugnini EP, Dragonetti E, Vincenzi B, et al: Pulse-mediated chemotherapy enhances local control and survival in a spontaneous canine model of primary mucosal melanoma, Melanoma Res 16:23, 2006.
- Esplin DG: Survival of dogs following surgical excision of histologically well-differentiated melanocytic neoplasms of the mucous membranes of the lips and oral cavity, Vet Pathol 45:889, 2008.
- Spangler WL, Kass PH: The histologic and epidemiologic bases for prognostic considerations in canine melanocytic neoplasia, Vet Pathol 43:136, 2006.
- MacMillan R, Withrow SJ, Gillette EL: Surgery and regional irradiation for treatment of canine tonsillar squamous cell carcinoma: retrospective review of eight cases, J Am Anim Hosp Assoc 18:311, 1982
- Beck ER, Withrow SJ, McChesney AE, et al: Canine tongue tumors: a retrospective review of 57 cases, J Am Anim Hosp Assoc 22:525, 1986.
- Brooks MB, Matus RE, Leifer CE, et al: Chemotherapy versus chemotherapy plus radiotherapy in the treatment of tonsillar squamous cell carcinoma in the dog, J Vet Intern Med 2:206, 1988.
- McCaw DL, Pope ER, Payne JT, et al: Treatment of canine oral squamous cell carcinomas with photodynamic therapy, Br J Cancer 82:1297, 2000.
- Evans SM, Shofer F: Canine oral nontonsillar squamous cell carcinoma, Vet Radiol 29:133, 1988.
- LaDue-Miller T, Price S, Page RL, et al: Radiotherapy for canine non-tonsillar squamous cell carcinoma, Vet Radiol Ultrasound 37:74, 1996.
- Bostock DE: The prognosis in cats bearing squamous cell carcinoma, J Small Anim Pract 13:119, 1972.
- Cotter SM: Oral pharyngeal neoplasms in the cat, J Am Anim Hosp Assoc 17:917, 1981.
- Hayes AM, Adams VJ, Scase TJ, et al: Survival of 54 cats with oral squamous cell carcinoma in United Kingdom general practice, J Small Anim Pract 48:394, 2007.
- Bregazzi VS, LaRue SM, Powers BE, et al: Response of feline oral squamous cell carcinoma to palliative radiation therapy, Vet Radiol Ultrasound 42:77, 2001.
- Nagata K, Selting KA, Cook CR, et al: 90Sr therapy for oral squamous cell carcinoma in two cats, Vet Radiol Ultrasound 52:114, 2011.
- Hilmas DE, Gillette EL: Radiotherapy of spontaneous fibrous connective-tissue sarcomas in animals, J Natl Cancer Inst 56:365, 1976.
- Creasey WA, Phil D, Thrall DE: Pharmacokinetic and anti-tumor studies with the radiosensitizer misonidazole in dogs with spontaneous fibrosarcomas, Am J Vet Res 43:1015, 1982.
- Heyman SJ, Diefenderfer DL, Goldschmidt MH, et al: Canine axial skeletal osteosarcoma: a retrospective study of 116 cases (1986 to 1989), Vet Surg 21:304, 1992.
- Hammer AS, Weeren FR, Weisbrode SE, et al: Prognostic factors in dogs with osteosarcomas of the flat and irregular bones, J Am Anim Hosp Assoc 31:321, 1995.
- Straw RC, Powers BE, Klausner J, et al: Canine mandibular osteosarcoma: 51 cases (1980-1992), J Am Anim Hosp Assoc 32:257, 1996.
- Kazmierski KJ, Dernell WS, Lafferty MH, et al: Osteosarcoma of the canine head: a retrospective study of 60 cases, Vet Cancer Soc Proc 22:30, 2002.
- Bostock DE, White RAS: Classification and behaviour after surgery of canine epulides, J Comp Pathol 97:197, 1987.
- Yoshida K, Watarai Y, Sakai Y, et al: The effect of intralesional bleomycin on canine acanthomatous epulis, J Am Anim Hosp Assoc 34:457, 1998.
- Reif JS, Cohen D: The environmental distribution of canine respiratory tract neoplasms, Arch Environ Health 22:136, 1971.
- Buhles WC, Theilan GH: Preliminary evaluation of bleomycin in feline and canine squamous cell carcinomas, Am J Vet Res 34:289, 1973.
- Mas A, Blackwood L, Cripps P, et al: Canine tonsillar squamous cell carcinoma: a multicentre retrospective review of 44 clinical cases, J Small Anim Pract 52:359, 2011.
- Dennis MM, Ehrhart N, Duncan CG, et al: Frequency of and risk factors associated with lingual lesions in dogs: 1,196 cases (1995-2004), J Am Vet Med Assoc 228:1533, 2006.
- Carpenter LG, Withrow SJ, Power BE, et al: Squamous cell carcinoma of the tongue in 10 dogs, J Am Anim Hosp Assoc 29:17, 1993.
- Brodey RS: A clinical and pathologic study of 130 neoplasms of the mouth and pharynx in the dog, Am J Vet Res 21:787, 1960.
- Solano M, Penninck DG: Ultrasonography of the canine, feline and equine tongue: normal findings and case history reports, Vet Radiol Ultrasound 37:206, 1996.
- Dvorak LD, Beaver DP, Ellison GW, et al: Major glossectomy in dogs: a case series and proposed classification system, J Am Anim Hosp Assoc 40:331, 2004.
- Turk MAM, Johnson GC, Gallina AM: Canine granular cell tumour (myoblastoma): a report of four cases and review of the literature, J Small Anim Pract 24:637, 1983.
- Patnaik AK, Lieberman PH, Erlandson RA, et al: A clinicopathologic and ultrastructural study of undifferentiated malignant tumors of the oral cavity in dogs, Vet Pathol 23:170, 1986.
- Ogilvie GK, Sundberg JP, O’Banion MK, et al: Papillary squamous cell carcinoma in three young dogs, J Am Vet Med Assoc 192:933, 1988.
- Norris AM, Withrow SJ, Dubielzig RR: Oropharyngeal neoplasms. In Harvey CE, editor: Oral disease in the dog and cat: veterinary dentistry, Philadelphia, 1985, Saunders.
- Calvert CA: Canine viral and transmissible neoplasias. In Greene CE, editor: Clinical microbiology and infectious diseases of the dog and cat, Philadelphia, 1984, Saunders.
- Poulet FM, Valentine BA, Summers BA: A survey of epithelial odontogenic tumors and cysts in dogs and cats, Vet Pathol 29:369, 1992.
- Dubielzig RR, Adams WM, Brodey RS: Inductive fibroameloblastoma, an unusual dental tumor of young cats, J Am Vet Med Assoc 174:720, 1979.
- Dernell WS, Hullinger GH: Surgical management of ameloblastic fibroma in the cat, J Small Anim Pract 35:35, 1994.
- Figueiredo C, Barros HM, Alvares LC, et al: Composed complex odontoma in a dog, Vet Med Small Anim Clin 69:268, 1974.
- Potter KA, Tucker RD, Carpenter JL: Oral eosinophilic granuloma of Siberian huskies, J Am Anim Hosp Assoc 16:595, 1980.
- Madewell BR, Stannard AA, Pulley LT, et al: Oral eosinophilic granuloma in Siberian husky dogs, J Am Vet Med Assoc 177:701, 1980.
- Bredal WP, Gunnes G, Vollset I, et al: Oral eosinophilic granuloma in three Cavalier King Charles spaniels, J Small Anim Pract 37:499, 1996.
- Scott DW: Chapter 11: Disorders of unknown or multiple origin, J Am Anim Hosp Assoc 16:406, 1980.
- McClelland RB: X-ray therapy in labial and cutaneous granulomas in cats, J Am Vet Med Assoc 125:469, 1954.
- MacEwen EG, Hess PW: Evaluation of effect of immunomodulation on the feline eosinophilic granuloma complex, J Am Anim Hosp Assoc 23:519, 1987.
- Song MD: Diagnosing and treating feline eosinophilic granuloma complex, Vet Med December:1141, 1994.
- Kapatkin AS, Matthiesen DT, Noone KE, et al: Results of surgery and long-term follow-up in 31 cats with nasopharyngeal polyps, J Am Anim Hosp Assoc 26:387, 1990.
- Kudnig ST: Nasopharyngeal polyps in cats, Clin Tech Small Anim Pract 17:174, 2002.
- Bradley RL, Noone KE, Saunders GK, et al: Nasopharyngeal and middle ear polypoid masses in five cats, Vet Surg 14:141, 1985.
- Harvey CE, Goldschmidt MH: Inflammatory polypoid growths in the ear canal of cats, J Small Anim Pract 19:669, 1978.
- Faulkner JE, Budsberg SC: Results of ventral bulla osteotomy for treatment of middle ear polyps in cats, J Am Anim Hosp Assoc 26:496, 1990.
- Parker NR, Binnington AG: Nasopharyngeal polyps in cats: three case reports and a review of the literature, J Am Anim Hosp Assoc 21:473, 1985.
- Trevor PB, Martin RA: Tympanic bulla osteotomy for treatment of middle ear disease in cats: 19 cases (1984-1991), J Am Vet Med Assoc 202:123, 1993.
- Mendenhall WM, Riggs CE, Cassissi NJ: Treatment of head and neck cancers. In DeVita RT, Hellman S, Rosenberg SA, editors: Cancer: Principles and practice of oncology, Philadelphia, 2005, Lippincott Williams & Wilkins.