Опухоли носовой полости и пазух — редкая патология у собак и кошек, успех в лечении которой во многом зависит от своевременности постановки диагноза, что затрудняется схожестью симптомов на ранней стадии болезни с другими заболеваниями.
В этой статье рассмотрены основные клинические признаки, способы диагностики и лечения опухолей носовой полости у собак и кошек.
Новообразования носовой полости и пазух у собак
Эпидемиология
- Опухоли носовой полости и пазух составляют примерно 1% от всех новообразований у собак (MacEwen EG et al. 1977);
- Средний возраст собак с данными опухолями составляет 10 лет, однако описаны случаи возникновения новообразований носовой полости в молодом возрасте (Patnaik AK et al. 1989; Lefebvre J et al. 2005);
- Предрасположены собаки средних и крупных пород (Patnaik AK et al. 1989);
- Есть данные о большей частоте встречаемости опухолей у кобелей (Strunzi H et al. 1976);

Патологическая характеристика и биологическое поведение
- Примерно в 2/3 всех случаев встречаются карциномы (раки), которые включают в себя аденокарциному, плоскоклеточный рак и недифференцированную карциному (Madewell BR et al. 1976). В остальных случаях встречаются саркомы (фибросаркома, хондросаркома, остеосаркома и недифференцированная саркома)(Patnaik AK et al. 1984);
- Для карцином и сарком характерен инвазивный рост. Метастатический потенциал считается низким и животные, как правило, погибают от локальной прогрессии опухоли. Однако у 40-50% животных обнаруживаются метастазы при проведении аутопсии (Patnaik AK et al. 1989). Типичными местами метастазирования являются регионарные лимфатические узлы и легкие, реже они отмечаются в костях, печени, коже и головном мозге (Patnaik AK et al. 1989, Henrt CJ et al. 1998; Hahn KA et al. 1997; Hahn KA et al. 1990; Northruo NC et al. 2001; Snyder MK et al. 2008);
- К редким описанным опухолям носовой полости и пазух относят круглоклеточные опухоли, такие как лимфома, мастоцитома, трансмиссивная венерическая саркома; гемангиосаркома, меланома, нейроэндокринная карцинома, опухоль оболочек периферических нервов, нейробластома, фиброзная гистиоцитома, мультилобулярная остеохондросаркома, гамартома, рабдомиосаркома и лейомиосаркома (Kaldrymidou E et al. 2000; Naganobu K. et al. 2000; Weir EC et al. 1978; Perez J et al. 1994; Ginel PJ et al. 1995; Papzoglou LG et al. 2001; Patnaik AK 1989; Patnaik AK et al. 2002; Miles MS et al. 2008; Hicks DG, Fidel JL 2006; Ueno H et al. 2007; Kitagawa M et al. 2006; LeRoith T. et al. 2009; Fujita M et al. 2008);
- Также могут встречаться такие доброкачественные новообразования, как полипы, фибромы, дермоидные кисты и ангиоматозная пролиферация.
Анамнез и клинические симптомы
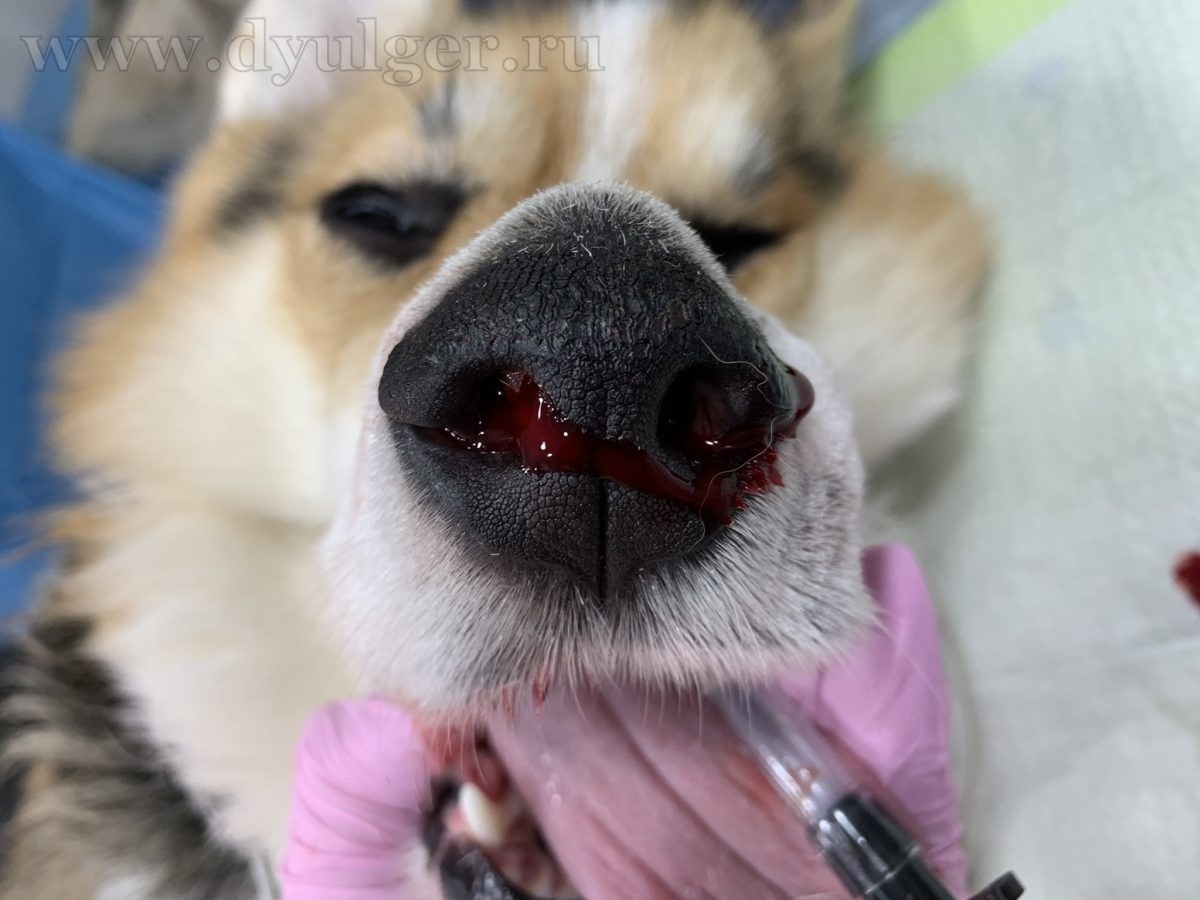
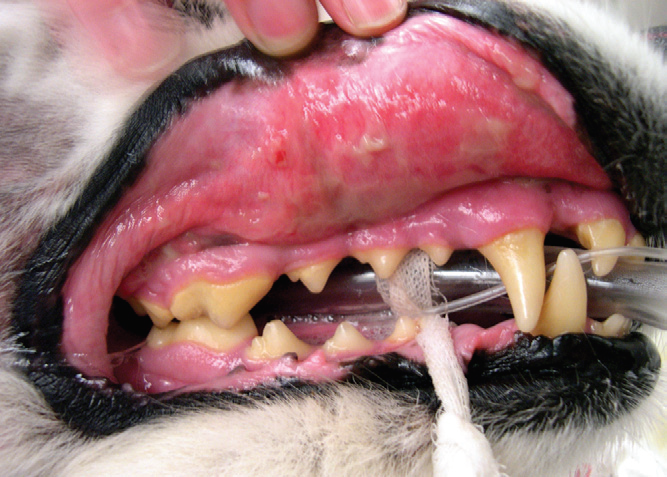
- Опухоль носовой полости стоит подозревать у всех пожилых животных с перемежающимися или прогрессирующими симптомами одностороннего эпистаксиса (в начале болезни) или носовых выделений различного характера (фото 2);
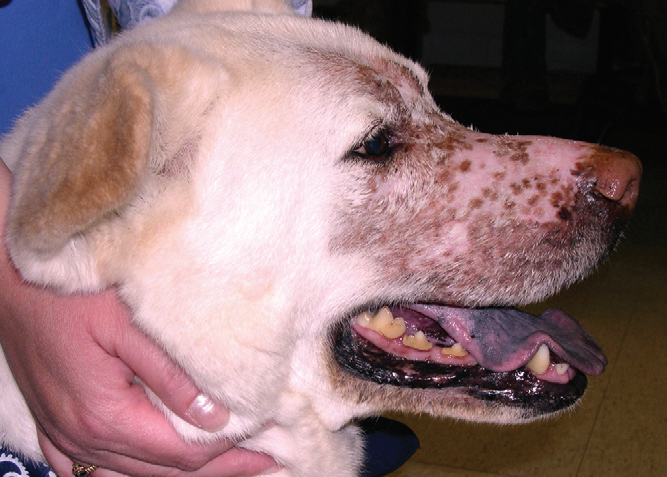
- Среднее время от момента появления первых клинических признаков ( эпистаксис, кровянистые или слизистые выделения из носа, деформацию лицевого отдела черепа, нежелание открывать рот, чиханье, затрудненное носовое дыхание, экзофтальм и эпифора) и постановки диагноза составляет 2-3 месяца (фото 1)(MacEwen EG et al. 1977; Patnaik AK 1989; Madewell BR et al. 1976; Ressnick KM et al. 2006);
- Дифференциальными диагнозами со схожими клиническими симптомами являются грибковый (Aspergillus sp.) или бактериальный ринит, идиопатический ринит (лимфоплазмоцитарный), нарушение свертываемости крови, гипертензия, инородные тела, травма и редкие генетические болезни (Saunders JH et al. 2003; Burrow RD 2004; Beck JA et al. 1999);
- Если у животного отмечается деформация лицевого отдела черепа, то это является характерным и достаточно специфичным признаком опухолевого процесса, однако такие симптомы могут отмечаться при заболевании аспергиллезом, споротрихозом и доброкачественной ангиоматозной пролиферации (Lobetti RG 2009; Strasser JL, Hawkins EC 2005);
- Собаки с носовым кровотечением и системными симптомами летаргии, кахексии, кровотечениями в других местах, неврологическими симптомами более вероятно имеют патологии свертывания крови, гипертензию или бактериальную инфекцию (Strasser JL, Hawkins EC 2005; Bissett SA et al. 2007);
- Выраженность клинических симптомов можно временно снизить при помощи антибиотиков, глюкокортикостероидов и нестероидных противовоспалительных средств. Частичная отдача на такое лечение не позволяет исключить онкологический процесс, который в той или иной степени, всегда сопровождается воспалением и вторичной инфекцией (Rassnick KM et al. 2006);
- В редких случаях, если опухоль распологается в каудальной части носовой полости или пазухах, могут наблюдаться неврологические симптомы (судороги, слепота, нарушение поведения, парезы, хождение по кругу и ступор), что связано с инвазией опухоли в ткани головного мозга. Верно и обратное, отсутствие неврологических симптомов не исключает инвазии опухоли носовой полости в головной мозг или решетчатую кость (Withrow SJ et al. 1985; Rudd RG, Richardson DC 1985);
Постановка диагноза и определение стадии заболевания
- Для постановки окончательного диагноза и определения типа опухоли необходимо провести биопсию;
- Патологии связанные с нарушением свертываемости крови необходимо исключить до проведения биопсии, так как процедура может спровоцировать у таких пациентов кровотечение;
- Стоит обратить внимание на количество тромбоцитов в крови, скорость остановки кровотечения после забора крови, наличие гематурии и петехий;
- При необходимости проводят исследование системы гемостаза (протромбиновое время, тромбиновое время, фибриноген, активированное частичное тромбопластиновое время);
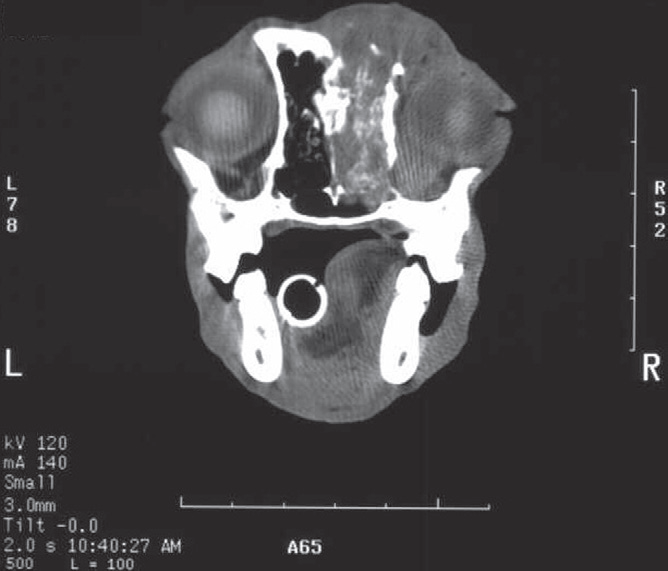
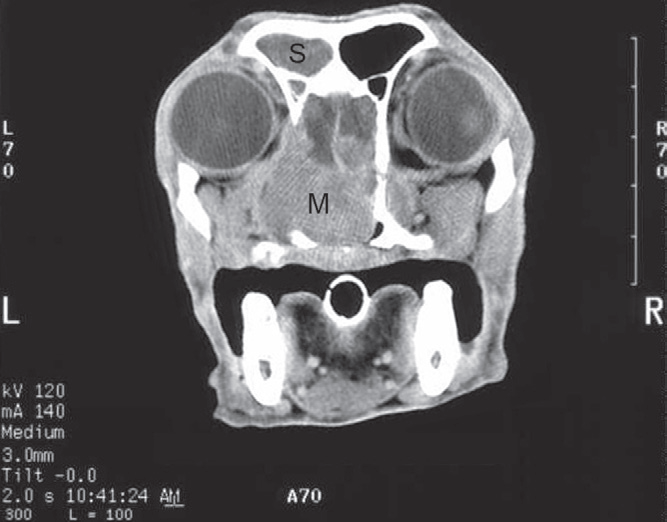
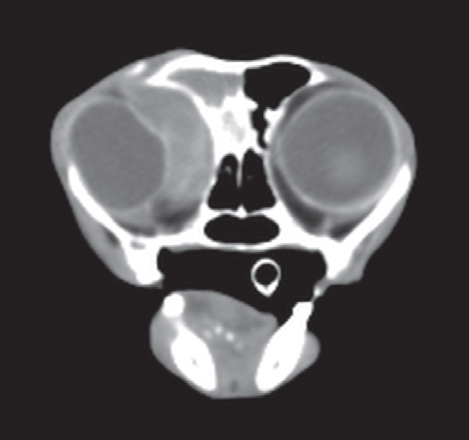
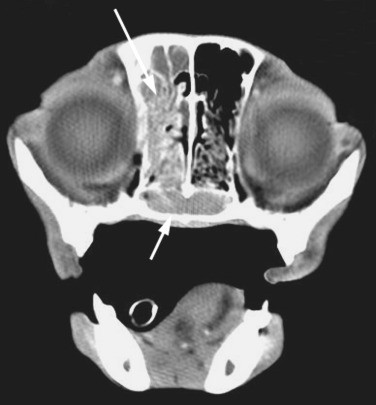
- Магнитно-резонансная и компьютерная томография (фото 3 и 4) позволяют получить детальную информацию о состоянии мягких тканей носовой полости и пазух, оценить размер новообразования и степень его инвазии в окружающие структуры (Thrall DE et al. 1989; Park RD et al. 1992; Codner EC et al. 1993; Drees R et al. 2009; Avner A et al. 2008; Agth P et al. 2009; Petite AFB et al. 2006; Burk RL 1992);
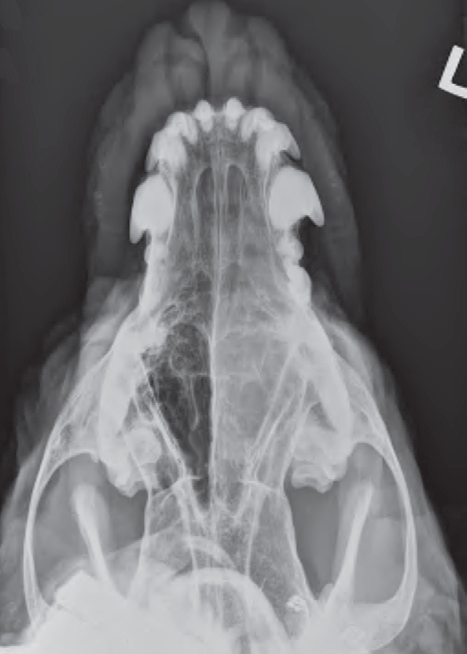
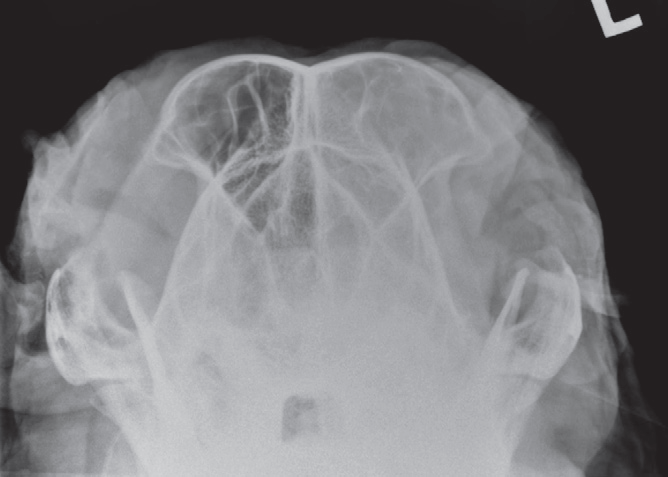
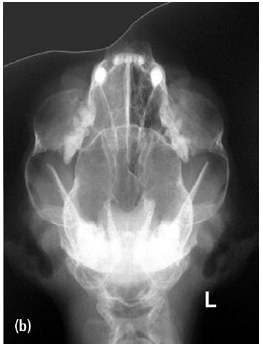
- Стандартные рентгенограммы могут быть использованы с целью оценки состояния носовой полости, однако они гораздо менее информативны по сравнению с томографией. Для оценки состояния носовой полости проводят снимки в боковой, вентродорсальной и других проекциях (с открытым ртом, косые проекции)(фото 5 и 6). Для получения качественных рентгеновских снимков необходимо проведение общей анестезии/седации;
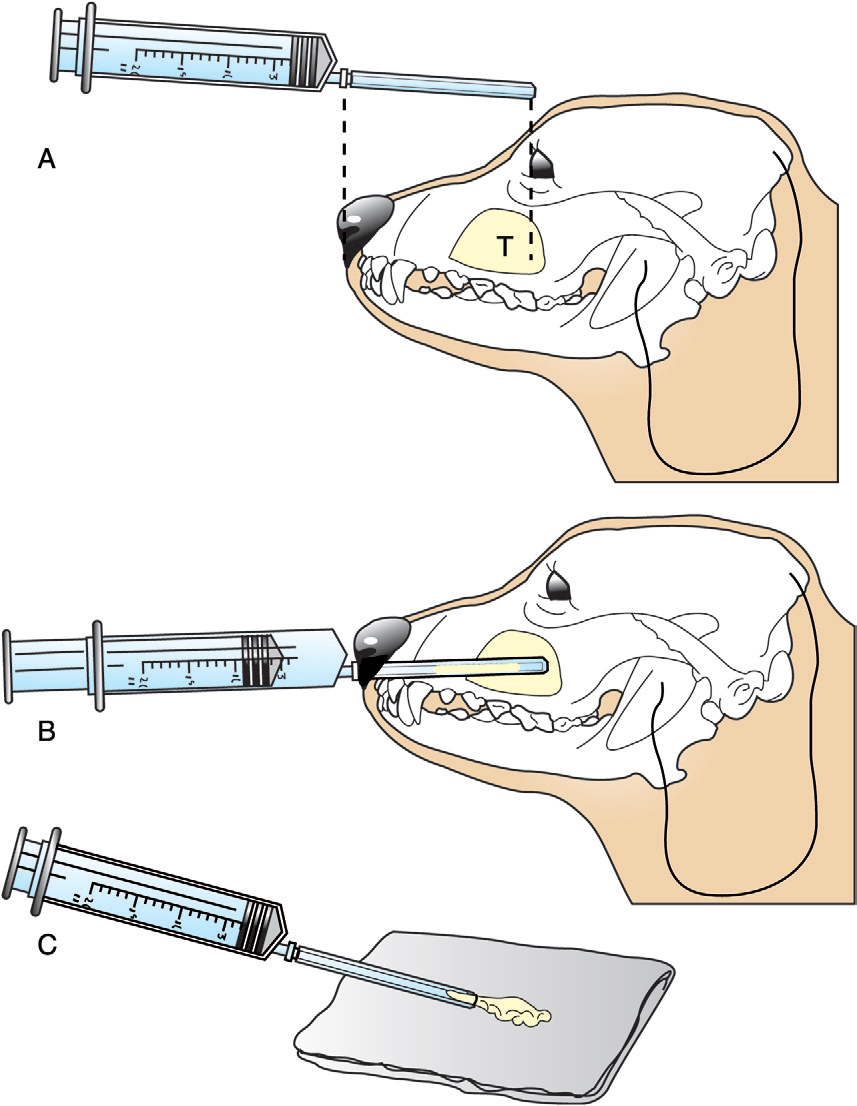
- Для получения гистологического материала проводят инцизионную, щипковою, сердцевидную (tru-cut)(видео 1) или трепан биопсию (фото 7). Забор материала можно проводить слепым или открытым методом, а также под контролем риноскопа;
Видео 1. Проведение Tru-cut биопсии у собаки с опухолью носовой полости.
- Существует несколько систем классификации опухолей носовой полости/синусов, которые основываются на опухолевом объеме и степени вовлечения в процесс окружающих костных структур/мягких тканей;
- Наименьшее клиническое значение имеет TNM классификация по Owen, так как описанные стадии первичной опухоли плохо коррелируют с прогнозом (Adams WM et al. 1998; Kondo Y et al. 2008; Couto CF et al. 1989);
- Более прикладное значение имеют классификации по Adams, основанные на данных КТ исследования, стадии которых лучше коррелируют с прогнозом, особенно если их комбинируют с результатами гистологического исследования (Adams WM et al. 2009);
- Метастатическое поражение регионарных лимфатических узлов отмечается в 10-24% случаев и более характерно для карцином носовой полости (Henry CJ et al. 1998; Rassnick KM et al. 2006; Buchholz J et al. 2009; LaDue TA et al. 1999);
- Необходимо провести забор материала из увеличенных регионарных лимфатических узлов для цитологического исследования, чтобы дифференцировать реактивную гиперплазия от метастазирования;
- Рентгенография (КТ) органов грудной клетки проводятся всем животным с опухолями носовой полости для исключения отдаленных метастазов, которые обычно отсутствую на этапе диагностики (Rassnick KM et al. 2006);
- Результаты общего клинического и биохимического анализов крови обычно неспецифичны у собак с опухолями носовой полости, в редких случаях может отмечаться паранеопластический эритроцитоз и гиперкальциемия (Couto CF et al. 1989; Wilson RB, Bronstad DC 1983; Anderson GM et al. 1999).
| TNM классификация по Owen | Классификация по Theon | Классификация по Adams | Модифицированная классификация по Adams |
|---|---|---|---|
| T: Первичная опухоль T0 — первичная опухоль не обнаружена T1 — Одностороннее поражение носового хода с минимальной или без инвазии в кость T2 — Двухстороннее поражение носовых ходов и/или выраженная инвазия в кость T3 — Инвазия во все окружающие ткани N: Состояние регионарных лимфатических узлов N0 — Нет признаков вовлечения в процесс лимфатических узлов N1 — Подвижные лимфатические узлы N2 — Фиксированные лимфатические узлы M: Отдаленные метастазы M0 — Нет признаков отдаленных метастазов M1 — Есть признаки отдаленных метастазов | 1 Стадия Одностороннее или двухстороннее носовых ходов без вовлечения носовых пазух 2 Стадия Двухстороннее новообразование носовых ходов с вовлечением в процесс носовых пазух и эрозией костной ткани | 1 Стадия Опухоль локализуется в одном носовом ходе или синусе без вовлечения в процесс костной ткани 2 Стадия Вовлечение в процесс костной ткани носовой полости, но без инвазии в подкожные/подслизистые ткани или орбиту 3 Стадия Вовлечение в процесс орбиты или подкожных/подслизистых тканей 4 Стадия Инвазия опухоли в носоглотку или решетчатую кость | 1 Стадия Поражение одного носового хода или синуса, но без разрушения костных тканей или носовых раковин 2 Стадия Вовлечение в процесс костной ткани носовой полости, но без инвазии в подкожные/подслизистые ткани или орбиту 3 Стадия Вовлечение в процесс орбиты или подкожных/подслизистых тканей 4 стадия Литическое поражение решетчатой кости |
| Клиническое значение | |||
| Первичное состояние опухоли (T) не является надежным прогностическим фактором | Опухоли во 2 стадии имеют в 2.3 раза больше шансов на рецидив по сравнению с 1 стадией | Медиана безрецидивного периода и продолжительности жизни: 1 и 2 стадия — 615 и 745 суток 3 и 4 — 745 и 315 суток | Вовлечение в процесс решетчатой кости значительно ухудшает прогноз и медиана продолжительности жизни составляет 6.7 месяцев (при первой стадии 23.4 месяца) |
Лечение и прогноз
- Основное лечение направлено на устранение первичной опухоли;
- Основная проблема заключается в том, что животные часто поступают на прием к врачу-онкологу уже с продвинутой стадией заболевания, что значительно усложняет лечение и ухудшает прогноз;
- Медиана продолжительности жизни животных без лечения составляет примерно 95 суток у собак с карциномами носовой полости (Rassnick KM et al. 2006);
- У животных с эпистаксисом прогноз хуже, чем у пациентов без него (медиана продолжительности жизни 88 суток против 224 суток)(Rassnick KM et al. 2006);
- Вовлечение в процесс окружающих костных тканей развивается достаточно быстро, что делает невозможным проведение излечивающей хирургии;
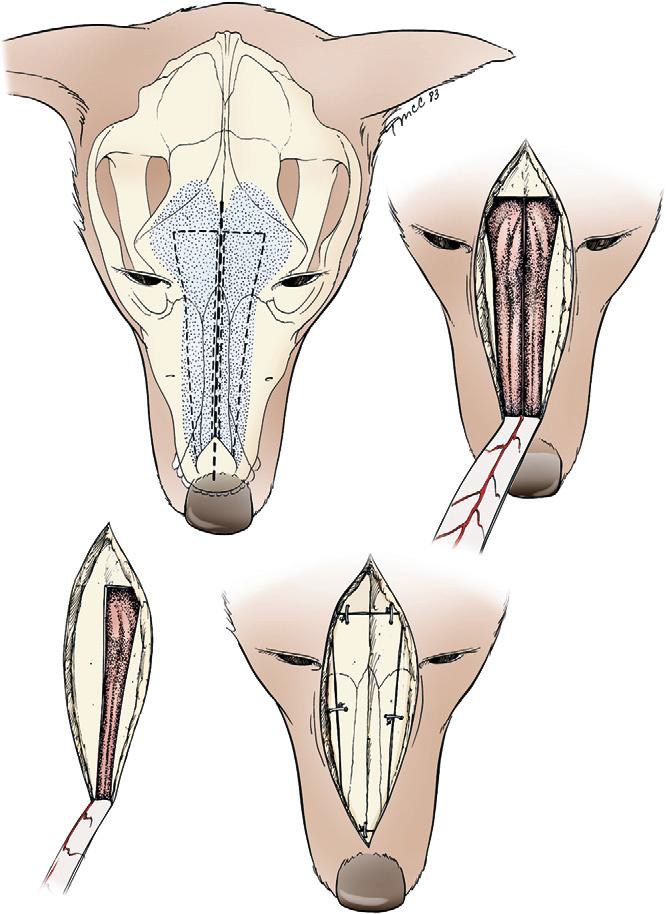
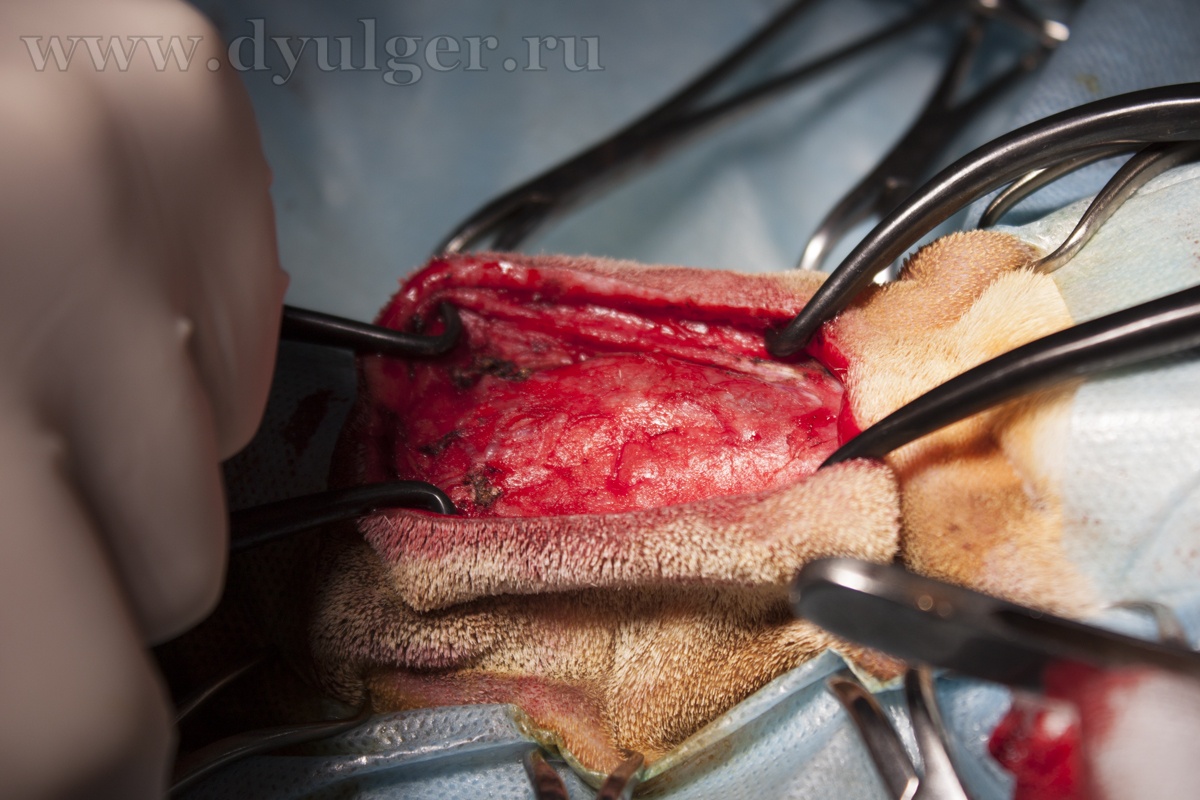
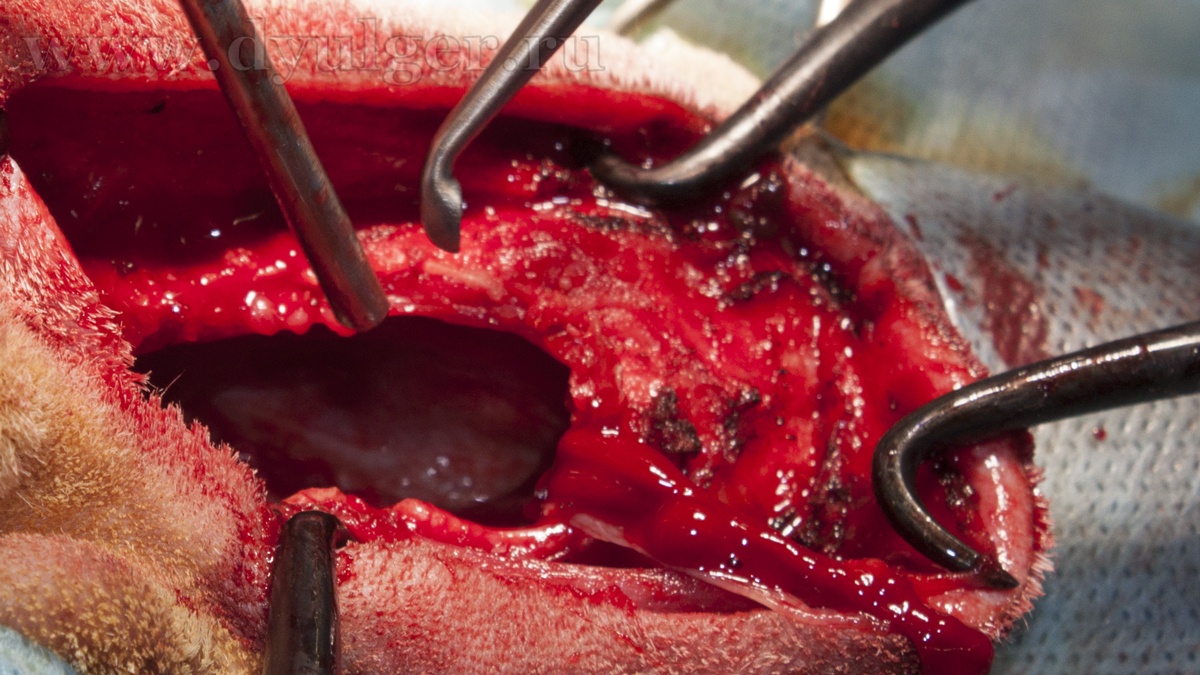
- В ряде случаев животным рекомендовано проведение ринотомии (фото 8 и 9) с циторедуктивной целью, однако такое оперативное вмешательство необходимо комбинировать с другими методами лечения, так как оно само по себе не увеличивает значительно медиану продолжительности жизни животного. Так например, медиана продолжительности жизни у таких животных составляет примерно 3-6 месяцев, что немногим больше по сравнению с пациентами без лечения (MacEwen et al. 1977; Henre CJ et al. 1998; Laing EJ et al. 1988; Holmberg DL et al. 1989);
- Сочетание хирургической операции и лучевой терапии позволяет значительно увеличить медиану продолжительности жизни животного (Adams WM et al. 1987);
- Однако более свежие исследования не выявили значимой разницы между лечением животных при помощи лучевой терапии в монорежиме и ее комбинации с хирургической операцией (Evans SM et al. 1989; Northrup NC et al. 2001)
- Лучевая терапия в монорежиме с использованием мегавольтажного источника излучения (кобальт) становится на данный момент методом выбора терапии животных с опухолями носовой полости/пазух. Медиана продолжительности жизни при полном курсе терапии (общая доза в 42-54 Гр, полученная в течение 10-18 сеансов по 3-4.2 Гр в течение 2-4 недель) составляет примерно 8-20 месяцев, а 1-а и 2-ух годичная выживаемость 43-68% и 11-44% соответственно (Theon AP et al. 1993; Adams WM et al. 1998; Adams WM et al. 2009; Evans SM et al. 1989; Lana SE et al. 2004; Adams WM et al. 2005; Lawrence JA et al. 2010);
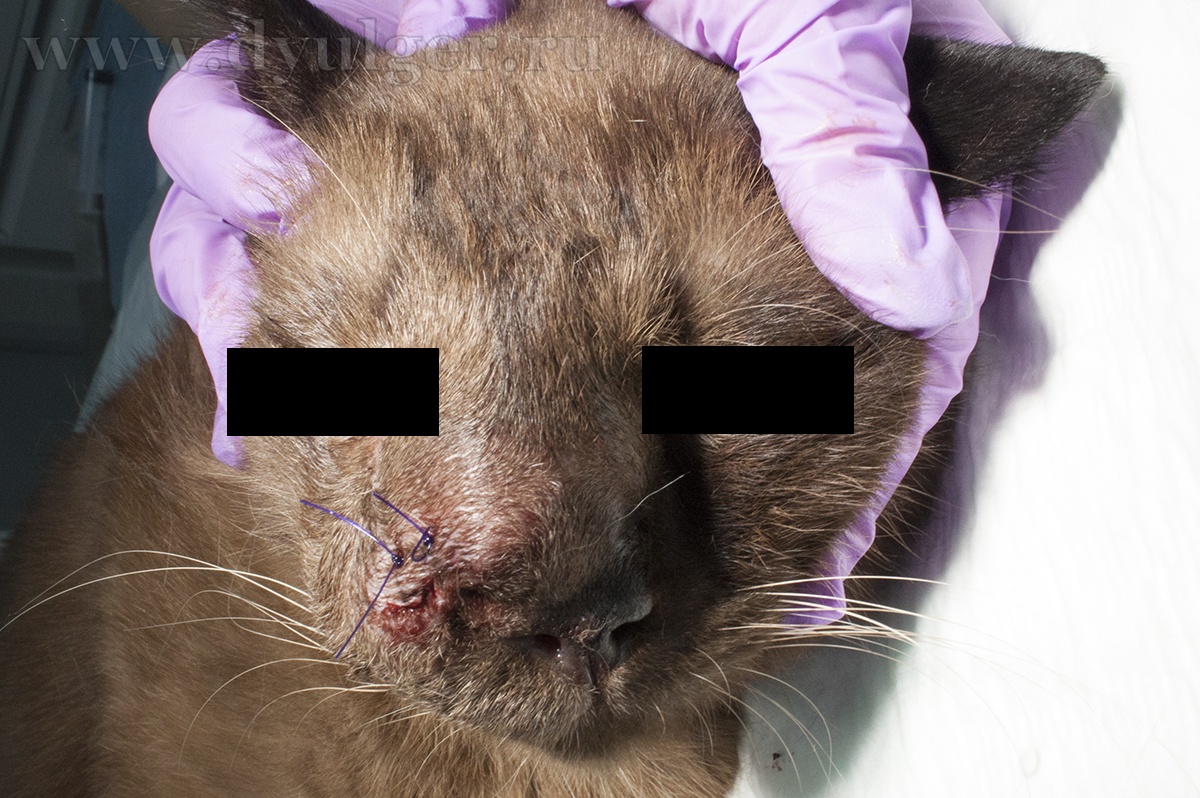
- Применение лучевой терапии связано с возможным развитием осложнений (Hall EJ, Giaccia AJ 2006). К острым токсическим явлениям облучения относят: мукозит, кератоконъюнктивит, блефарит, ринит, десквамация кожного эпителия. К возможным отдаленным (через 6-9 месяцев) патологиям лучевой терапии относят развитие катаракты, кератита, атрофии роговицы, сухого кератоконъюнктивита, увеита, дегенерации сетчатки, повреждения нервных и костных тканей, а также фиброза кожи (фото 10 и 11);
- Существуют также паллиативные протоколы лучевой терапии, которые нацелены на улучшение качества жизни животного и минимизации развития возможных осложнений. Применение недельных доз в 6-9 Гр позволяет улучшить клинические симптомы болезни в 66-100% случаев. Медиана продолжительности жизни составляет примерно 146-300 суток (Mellanby RJ et al. 2002; Geiger T et al. 2008; Maruo T et al. 2011);
- Химиотерапию редко используют для лечения опухолей носовой полости у собак. Применение цисплатина показала некоторую эффективность с частотой ответа на лечение в 27%. Медиана продолжительности жизни составила 4 месяца (Hahn KA et al. 1992);
- В другом исследовании применяли комбинацию из доксорубицина, цисплатина и пироксикама. Ответ на терапию наблюдался в 75% случаев, у 50% животных была полная ремиссия по результатам КТ. Медиана продолжительности жизни составила 210 суток (150-960 суток)(Langova V et al. 2004);
- Если у животного развивается неконтролируемое носовое кровотечение из опухоли, то может потребоваться лигация одной/двух сонных артерий или селективная эмболизаиця веток верхнечелюстной артерии;
- К негативным прогностическим факторам относят: возраст (старше 10 лет), эпистаксис, продвинутая локальная стадия заболевания, наличие метастазов, гистологический тип опухоли (карцинома, плоскоклеточный рак, недифференцированная карцинома), поражение решетчатой кости и отсутствие отдачи на лечение.
Опухоли носовой полости и пазух у кошек
- У кошек опухоли носовой полости/пазух в 90% являются злокачественными. Предрасположены пожилые животные с возрастной медианой в 9-10 лет. Для данных новообразований характерен инвазивный рост с низкой тенденцией к метастазированию (Hendeson SM et al. 2004; Mukaratirwa S et al. 2001; Demko JL et al. 2007; Theon AP. et al. 1994);
- Клинические симптомы опухолей носовой полости неспецифические и характерны для ряда других патологий: выделения из носа, нарушение носового дыхания, чихание, эпистаксис, деформация лица, эпифора и потеря веса (Taylor SS et al. 2009; Sfiligoi G et al. 2007; Haney SM et al. 2009);
- Длительность симптомов обычно составляет несколько месяцев до момента постановки диагноза и может наблюдаться некоторая отдача на лечение антибиотиками или глюкокортикостероидами;
- Дифференциальными диагнозами являются: хронический ринит, инфекционный (грибковый) ринит, инородное тело, воспалительный полип, назофарингеальный стеноз и травма;
- Лимфома (фото 12 и 13) является самой распространенной опухолью носовой полости и синусов, далее идут новообразования эпителиального происхождения (карцинома, аденокарцинома, плоскоклеточный рак). Реже встречаются саркомы (фибросаркома, остеосаркома, хондросаркома), мастоцитомы, меланомы, плазмацитомы, нейробластомы и такие доброкачественные поражения как гамартома, хондрома и нейрофиброма (Little L et al. 2007; Greci V et al. 2011);
- Диагностические принципы схожие с таковыми у собак. Для постановки диагноза необходимо провести биопсию. Цитологические исследования показали свою эффективность в ряде исследований, однако гистологическое исследование все равно остается методом выбора (DeLorenzi D et al. 2008);
- В одном исследовании лимфом у кошек, было обнаружено, что 91% опухолей является иммунобластной лимфомой (в 68% B-клеточная, 20% T-клеточная и 12% смешанная популяция клеток)(Little L et al. 2007);
- Рентгенография (фото 16) может быть использована в качестве метода визуализации носовой полости, однако в большинстве обладает низкой диагностической чувствительностью и специфичностью (Lamb CR et al. 2003). Компьютерная томография (фото 14 и 15) является более чувствительным методом диагностики новообразований носовой полости, что было показано в ряде исследований (Schoenborn WC et al. 2003; Tromblee TC et al. 2006; Karnikl K et al. 2009). Магнитно-резонансная томография тоже является информативным методом диагностики, особенно если у животного наблюдаются неврологические симптомы;
- Увеличенные регионарные лимфатические узлы необходимо также исследовать методом цитологии, для дифференциации реактивной гиперплазии от метастатического поражения;
- Также как и у собак — лучевая терапия является методом выбора локального лечения опухолей. В одном исследовании 16 кошек с нелимфопролиферативными опухолями проходили лечение при помощи лучевой терапии (общая доза 48 Гр). Терапия хорошо переносилась животными, медиана продолжительности жизни составила 12 месяцев, 44% и 16% кошек прожили более 1-го и 2-ух лет соответственно (Theon AP et al. 1994). В другом схожем исследовании медиана продолжительности жизни составила 13 месяцев и 63% животных прожило больше года (Mellanby RJ et al. 2002);
- Существует несколько публикаций о лечении лимфомы носовых ходов у кошек при помощи лучевой и/или химиотерапии. Несмотря на различные протоколы, ответ на лечение наблюдался примерно в 70-90% случаев. Дополнительное использование лучевой терапии позволяет продлить медиану продолжительности жизни животного на 174-955 суток (Taylor SS et al. 2009; Sfiligoi G et al. 2007; Haney SM et al. 2009; Little L et al. 2007; Elmslie RE et al. 1991);

Литература
- MacEwen EG, Withrow SJ, Patnaik AK: Nasal tumors in the dog: retrospective evaluation of diagnosis, prognosis, and treatment, J Am Vet Med Assoc 170:45–48, 1977.
- Patnaik AK: Canine sinonasal neoplasms: Clinicopathological study of 285 cases, J Am Anim Hosp Assoc 25:103–114, 1989.
- Lefebvre J, Kuehn NJ, Wortinger A: Computed tomography as an aid in the diagnosis of chronic nasal disease in dogs, J Small Anim Pract 46:280–285, 2005.
- Strunzi H, Hauser B: Tumors of the nasal cavity, Bull World Health Organ 53:257–263, 1976.
- Madewell BR, Priester WA, Gillette EL, et al: Neoplasms of the nasal passages and paranasal sinuses in domesticated animals as reported by 13 veterinary colleges, Am J Vet Res 851–856, 1976.
- Patnaik AK, Lieberman PH, Erlandson RA, et al: Canine sinonasal skeletal neoplasms: Chondrosarcomas and osteosarcomas, Vet Pathol 21:475–482, 1984.
- Henry CJ, Brewer WG, Tyler JW, et al: Survival in dogs with nasal adenocarcinoma: 64 cases (1981-1995), J Vet Intern Med 12:436–439, 1998.
- Hahn KA, Matlock CL: Nasal adenocarcinoma metastatic to bone in two dogs, J Am Vet Med Assoc 197(4):491–494, 1990.
- Hahn KA, McGavin MD, Adams WH: Bilateral renal metastases of nasal chondrosarcoma in a dog, Vet Pathol 34:352–355, 1997.
- Northrup NC, Etue SM, Ruslander DM, et al: Retrospective study of orthovoltage radiation therapy for nasal tumors in 42 dogs, J Vet Intern Med 15:183–189, 2001.
- Snyder MK, Lipitz L, Skorupski KA et al: Secondary intracranial neoplasia in the dog: 177 cases (1986-2003), J Vet Intern Med 22:172–177, 2008.
- Kaldrymidou E, Papaioannou N, Poutahidis T, et al: Malignant lymphoma in nasal cavity and paranasal sinuses of a dog, J Vet Med A Physiol Pathol Clin Med 47(8):457–462, 2000.
- Naganobu K, Ogawa H, Uchida K, et al: Mast cell tumor in the nasal cavity of a dog, J Vet Med Sci 62(9):1009–1011, 2000.
- Weir EC, Pond MJ, Duncan JR, et al: Extragenital occurrence of transmissible venereal tumor in the dog: literature review and case reports, J Am Anim Hosp Assoc 14:532–536, 1978.
- Perez J, Bautista MJ, Carrasco L, et al: Primary extragenital occurrence of transmissible venereal tumors: three case reports, Can Pract 19(1):7–10, 1994.
- Ginel PJ, Molleda JM, Novales M, et al: Primary transmissible venereal tumour in the nasal cavity of a dog, Vet Rec 136:222–223, 1995.
- Papzoglou LG, Koutinas AF, Plevraki AG, et al: Primary intranasal transmissible venereal tumour in the dog: a retrospective study of six spontaneous cases, J Vet Med A Physiol Pathol Clin Med 48(7):391–400, 2001.
- Patnaik AK: Canine sinonasal neoplasms: soft tissue tumors, J Am Anim Hosp Assoc 25:491–497, 1989.
- Patnaik AK, Ludwig LL, Erlandson RA: Neuroendocrine carcinoma of the nasopharynx in a dog, Vet Pathol 39:496–500, 2002.
- Miles MS, Dhaliwal RS, Moore MP, et al: Association of magnetic resonance imaging findings and histologic diagnosis in dogs with nasal disease: 78 cases (2001-2004), J Am Vet Med Assoc 232:1844– 1849, 2008.
- Hicks DG, Fidel JL: Intranasal malignant melanoma in a dog, J Am Anim Hosp Assoc 42:472–476, 2006.
- Ueno H, Kobayashi Y, Yamada K: Olfactory esthesioneuroblastoma treated with orthovoltage radiotherapy in a dog, Aust Vet J 85:271–275, 2007.
- Kitagawa M, Okada M, Yamamura H, et al: Diagnosis of olfactory neuroblastoma in a dog by magnetic resonance imaging, Vet Rec 159:288–289, 2006.
- LeRoith T, Binder EM, Graham AH, et al: Respiratory epithelial adenomatoid hamartoma in a dog, J Vet Diagn Invest 21:918–920, 2009.
- Fujita M, Takaishi Y, Yasuda D, et al: Intranasal hemangiosarcoma in a dog, J Vet Med Sci 70:525–528, 2008.
- Rassnick KM, Goldkamp CE, Erb HN, et al: Evaluation of factors associated with survival in dogs with untreated nasal carcinomas: 139 cases (1993-2003), J Am Vet Med Assoc 229:401–406, 2006.
- Saunders JH, Van Bree H, Gielen I, et al: Diagnostic value of computed tomography in dogs with chronic nasal disease, Vet Radiol Ultrasound 44(4):409–413, 2003.
- Burrow RD: A nasal dermoid sinus in an English bull terrier, J Small Anim Pract 45(11):572–574, 2004.
- Beck JA, Hunt GB, Goldsmid SE, et al: Nasopharyngeal obstruction due to cystic Rathke’s clefts in two dogs, Aust Vet J 77:94–96, 1999.
- Lobetti RG: A retrospective study of chronic nasal disease in 75 dogs, J S Afr Vet Assoc 80:224–228, 2009.
- Strasser JL, Hawkins EC: Clinical features of epistaxis in dogs: a retrospective study of 35 cases (1999-2002), J Am Anim Hosp Assoc 41:179–184, 2005.
- Bissett SA, Drobatz KJ, McKnight A, et al: Prevalence, clinical features, and causes of epistaxis in dogs: 176 cases (1996-2001), J Am Vet Med Assoc 231:1843–1850, 2007.
- Thrall DE, Robertson ID, McLeod DA, et al: A comparison of radiographic and computed tomographic findings in 31 dogs with malignant nasal cavity tumors, Vet Radiol 30:59–66, 1989.
- Park RD, Beck ER, LeCouteur RA: Comparison of computed tomography and radiography for detecting changes induced by malignant nasal neoplasia in dogs, J Am Vet Med Assoc 201:1720– 1724, 1992.
- Codner EC, Lurus AG, Miller JB, et al: Comparison of computed tomography with radiography as a noninvasive diagnostic technique for chronic nasal disease in dogs, J Am Vet Med Assoc 202:1106– 1110, 1993.
- Drees R, Forrest LJ, Chappell R: Comparison of computed tomography and magnetic resonance imaging for the evaluation of canine intranasal neoplasia, J Small Anim Pract 50:334–340, 2009.
- Avner A, Dobson JM, Sales JI, et al: Retrospective review of 50 canine nasal tumours evaluated by low-field magnetic resonance imaging, J Small Anim Pract 49:233–239, 2008.
- Agthe P, Caine AR, Gear RNA, et al: Prognostic significance of specific magnetic resonance imaging features in canine nasal tumours treated by radiotherapy, J Small Anim Pract 50:641–648, 2009.
- Petite AFB, Dennis R: Comparison of radiography and magnetic resonance imaging for evaluating the extent of nasal neoplasia in dogs, J Small Anim Pract 47:529–536, 2006.
- Burk RL: Computed tomographic imaging of nasal disease in 100 dogs., Vet Radiol Ultrasound 33(3):177–180, 1992.
- Withrow SJ, Susaneck SJ, Macy DW, et al: Aspiration and punch biopsy techniques for nasal tumors, J Am Anim Hosp Assoc 21:551–554, 1985.
- Rudd RG, Richardson DC: A diagnostic and therapeutic approach to nasal disease in dogs, Compend Contin Educ Pract Vet 7:103–112, 1985.
- Theon AP, Madewell BR, Harb MF, et al: Megavoltage irradiation of neoplasms of the nasal and paranasal cavities in 77 dogs, J Am Vet Med Assoc 202:1469–1475, 1993.
- Adams WM, Miller PE, Vail DM, et al: An accelerated technique for irradiation of malignant canine nasal and paranasal sinus tumors, Vet Radiol Ultrasound 39:475–481, 1998.
- Adams WM, Kleiter MM, Thrall DE, et al: Prognostic significance of tumor histology and computed tomographic staging for radiation treatment response of canine nasal tumors, Vet Radiol Ultrasound 50:330–335, 2009.
- Owen LN: TNM Classification of tumors in domestic animals, Geneva, 1980, World Health Organization.
- Theon AP, Madewell BR, Harb MF, et al: Megavoltage irradiation of neoplasms of the nasal and paranasal cavities in 77 dogs, J Am Vet Med Assoc 202:1469–1475, 1993.
- Adams WM, Miller PE, Vail DM, et al: An accelerated technique for irradiation of malignant canine nasal and paranasal sinus tumors, Vet Radiol Ultrasound 39:475–481, 1998.
- Adams WM, Kleiter MM, Thrall DE, et al: Prognostic significance of tumor histology and computed tomographic staging for radiation treatment response of canine nasal tumors, Vet Radiol Ultrasound 50:330–335, 2009.
- Buchholz J, Hagen R, Leo C, et al: 3D conformal radiation therapy for palliative treatment of canine nasal tumors, Vet Radiol Ultrasound 50:679–683, 2009.
- Kondo Y, Matsunaga S, Mochizuki M, et al: Prognosis of canine patients with nasal tumors according to modified clinical stages based on computed tomography: a retrospective study, J Vet Med Sci 70:207–212, 2008.
- LaDue TA, Dodge R, Page RL, et al: Factors influencing survival after radiotherapy of nasal tumors in 130 dogs, Vet Radiol Ultrasound 40:312–317, 1999.
- Couto CF, Boudrieau RJ, Zanjani ED: Tumor-associated erythrocytosis in a dog with nasal fibrosarcoma, J Vet Intern Med 3:183–185, 1989.
- Wilson RB, Bronstad DC: Hypercalcemia associated with nasal adenocarcinoma in a dog, J Am Vet Med Assoc 182:1246–1247, 1983.
- Anderson GM, Lane I, Fischer J, et al: Hypercalcemia and parathyroid hormone-related protein in a dog with undifferentiated nasal carcinoma, Can Vet J 40:341–342, 1999.
- Laing EJ, Binnington AG: Surgical therapy of canine nasal tumors: a retrospective study (1982-1986), Can Vet J 29:809–813, 1988.
- Holmberg DL, Fries C, Cockshutt J, et al: Ventral rhinotomy in the dog and cat, Vet Surg 18:446–449, 1989.
- Adams WM, Withrow SJ, Walshaw R, et al: Radiotherapy of malignant nasal tumors in 67 dogs, J Am Vet Med Assoc 191:311– 315, 1987.
- Evans SM, Goldschmidt M, McKee LJ, et al: Prognostic factors and survival after radiotherapy for intranasal neoplasms in dogs: 70 cases (1974-1985), J Am Vet Med Assoc 194:1460–1463, 1989.
- McEntee MC, Page RL, Heidner GL, et al: A retrospective study of 27 dogs with intranasal neoplasms treated with cobalt radiation, Vet Radiol Ultrasound 32:135–139, 1991.
- Lana SE, Dernell WS, Lafferty MS, et al: Use of radiation and a slow-release cisplatin formulation for treatment of canine nasal tumors, Vet Radiol Ultrasound 45:1–5, 2004.
- Adams WM, Bjorling DE, McAnulty JF, et al: Outcome of accelerated radiotherapy alone or accelerated radiotherapy followed by exenteration of the nasal cavity in dogs with intranasal neoplasia: 53 cases (1993-2002), J Am Vet Med Assoc 227:936–941, 2005.
- Lawrence JA, Forrest LJ, Turek MM, et al: Proof of principle of ocular sparing in dogs with sinonasal tumors treated with intensity-modulated radiation therapy, Vet Radiol Ultrasound 51:561–570, 2010.
- Mellanby RJ, Stevenson RK, Herrtage ME, et al: Long-term outcome of 56 dogs with nasal tumours treated with four doses of radiation at intervals of seven days, Vet Rec 151:253–257, 2002.
- Geiger T, Rassnick K, Siegel S, et al: Palliation of clinical signs in 48 dogs with nasal carcinomas treated with coarse-fraction radiation therapy, J Am Anim Hosp Assoc 44:116–123, 2008.
- Maruo T, Shida T, Fukuyama Y, et al: Retrospective study of canine nasal tumor treated with hypofractionated radiotherapy, J Vet Med Sci 73:193–197, 2011.
- Morris JS, Dunn KJ, Dobson JM, et al: Effects of radiotherapy alone and surgery and radiotherapy on survival of dogs with nasal tumours, J Small Anim Pract 35:567–573, 1994.
- Nadeau M, Kitchell BE, Rooks RL, et al: Cobalt radiation with or without low-dose cisplatin for treatment of canine naso-sinus carcinomas, Vet Radiol Ultrasound 45(4):362–367, 2004.
- Yoon JH, Feeney DA, Jessen CR, et al: External-beam Co-60 radiotherapy for canine nasal tumors: a comparison of survival by treatment protocol, Res Vet Sci 84:140–149, 2008.
- Hunley DW, Mauldin GN, Shiomitsu K, et al: Clinical outcome in dogs with nasal tumors treated with intensity-modulated radiation therapy, Can Vet J 51:293–300, 2010.
- Hall EJ, Giaccia AJ: Time, dose, and fractionation in radiotherapy. In Hall EJ, et al, editors: Radiobiology for the radiologist, ed 6, Philadelphia, 2006, Lippincott Williams & Wilkins.
- Thrall DE, McEntee MC, Novotney C: A boost technique for irradiation of malignant canine nasal tumors, Vet Radiol Ultrasound 34(4):295–300, 1993.
- Jamieson VE, Davidson MG, Nasisse MP, et al: Ocular complications following cobalt 60 radiotherapy of neoplasms in the canine head region, J Am Anim Hosp Assoc 27:51–55, 1991.
- Ching SV, Gillette SM, Powers BE, et al: Radiation-induced ocular injury in the dog: a histological study, Int J Radiation Oncology Biol Phys 19:321–328, 1990.
- Roberts SM, Lavach JD, Severin GA, et al: Ophthalmic complications following megavoltage irradiation of the nasal and paranasal cavities in dogs, J Am Vet Med Assoc 100:43–47, 1987.
- Thrall DE, Heidner GL, Novotny CA, et al: Failure patterns following cobalt irradiation in dogs with nasal carcinoma, Vet Radiol Ultrasound 34(2):126–133, 1993.
- LeBlanc AK, LaDue TA, Turrel JM, et al: Unexpected toxicity following use of gemcitabine as a radiosensitizer in head and neck carcinomas: a veterinary radiation therapy oncology group pilot study, Vet Radiol Ultrasound 45(5):466–470, 2004.
- McEntee MC: Veterinary radiation therapy: Review and current state of the art, J Am Anim Hosp Assoc 42:94–109, 2006.
- Hong TS, Ritter MA, Tome WA, et al: Intensity-modulated radiation therapy: emerging cancer treatment technology, Br J Cancer 92:1819–1824, 2005.
- Vaudaux C, Schneider U, Kaser-Hotz B: Potential for intensitymodulated radiation therapy to permit dose escalation for canine nasal cancer, Vet Radiol Ultrasound 48:475–481, 2007.
- Guttierrez AN, Deveau M, Forrest LJ, et al: Radiobiological and treatment planning study of a simultaneously integrated boost for canine nasal tumors using helical tomotherapy, Vet Radiol Ultrasound 48:594–602, 2007.
- Deveau MA, Gutierrez AN, Mackie TR, et al: Dosimetric impact of daily setup variations during treatment of canine nasal tumors using intensity-modulated radiation therapy, Vet Radiol Ultrasound 51:90–96, 2010.
- Harmon J, Van Ufflen D, LaRue S: Assessment of a radiotherapy patient cranial immobilization device using daily on-board kilovoltage imaging, Vet Radiol Ultrasound 50:230–234, 2009.
- Rohrer Bley C, Blattmann H, Roos M, et al: Assessment of a radiotherapy patient immobilization device using single plane port radiographs and a remote computed tomography scanner, Vet Radiol Ultrasound 44:470–475, 2003.
- Kippenes H, Gavin PR, Sande RD, et al: Comparison of the accuracy of positioning devices for radiation therapy of canine and feline head tumors, Vet Radiol Ultrasound 41:371–376, 2000.
- Kent MS, Gordon IK, Benavides I, et al: Assessment of the accuracy and precision of a patient immobilization device for radiation therapy in canine head and neck tumors, Vet Radiol Ultrasound 50:550–554, 2009.
- Forrest LJ, Mackie TR, Ruchala K, et al: The utility of megavoltage computed tomography images from a helical tomotherapy system for setup verification purposes, Int J Radiat Oncol Biol Phys 60:1639–1644, 2004.
- Martin A, Gaya A: Stereotactic body radiotherapy: A review, Clin Oncol 22:157–172, 2010.
- Personal Communication: Custis J, Harmon J, Ryan S, et al: Stereotactic radiation therapy for the treatment of canine nasal tumors, Vet Cancer Soc Proc 30:46, 2010.
- Personal Communication: Charney S, Witten M, Ettinger S, et al: Cyber knife radiosurgery for irradiation of tumors in dogs and cats, Vet Cancer Soc Proc 30:97, 2010.
- Bommarito DA, Kent MS, Selting KA, et al: Reirradiation of recurrent canine nasal tumors, Vet Radiol Ultrasound 52:207–212, 2011.
- Hahn KA, Knapp DW, Richardson RC, et al: Clinical response of nasal adenocarcinoma to cisplatin chemotherapy in 11 dogs, J Am Vet Med Assoc 200:355–357, 1992.
- Langova V, Mutsaers AJ, Phillips B, et al: Treatment of eight dogs with nasal tumours with alternating doses of doxorubicin and carboplatin in conjunction with oral piroxicam, Aust Vet J 82:676–680, 2004.
- Mayer-Stankeova S, Fidel J, Wergin MC, et al: Proton spot scanning radiotherapy of spontaneous canine tumors, Vet Radiol Ultrasound 50:314–318, 2009.
- White R, Walker M, Legendre AM, et al: Development of brachytherapy technique for nasal tumors in dogs, Am J Vet Res 51:1250–1256, 1990.
- Thompson JP, Ackerman N, Bellah JR, et al: 192Iridium brachytherapy, using an intracavitary afterload device, for treatment of intranasal neoplasms in dogs, Am J Vet Res 53:617–622, 1992.
- Withrow SJ: Cryosurgical therapy for nasal tumors in the dog, J Am Anim Hosp Assoc 18:585–589, 1982.
- Murphy SM, Lawrence JA, Schmiedt CW, et al: Image-guide transnasal cryoablation of a recurrent nasal adenocarcinoma in a dog, J Small Anim Pract 52:329–333, 2011.
- Lucroy MD, Long KR, Blaik MA, et al: Photodynamic therapy for the treatment of intranasal tumors in 3 dogs and 1 cat, J Vet Intern Med 17:727–729, 2003.
- Osaki T, Takagi S, Hoshino Y, et al: Efficacy of antivascular photodynamic therapy using benzoporphyrin derivative monoacid ring A (BPD-MA) in 14 dogs with oral and nasal tumors, J Vet Med Sci 71:125–132, 2009.
- Thrall DE, Harvey CE: Radiotherapy of malignant nasal tumors in 21 dogs, J Am Vet Med Assoc 183:663–666, 1983.
- Henderson SM, Bradley K, Day MJ, et al: Investigation of nasal disease in the cat—a retrospective study of 77 cases, J Feline Med Surg 6:245–257, 2004.
- Mukaratirwa S, van der Linde-Sipman JS, Gruys E: Feline nasal and paranasal sinus tumors: clinicopathological study, histomorphological description and diagnostic immunohistochemistry of 123 cases, J Feline Med Surg 3:235–245, 2001.
- Demko, JL, Cohn LA: Chronic nasal discharge in cats: 75 cases (1993-2004), J Am Vet Med Assoc 230:1032–1037, 2007.
- Theon AP, Peaston AE, Madewell BR, et al: Irradiation of nonlymphoproliferative neoplasms of the nasal cavity and paranasal sinuses in 16 cats, J Am Vet Med Assoc 204:78–83, 1994.
- Taylor SS, Goodfellow MR, Browne WJ, et al: Feline extranodal lymphoma: response to chemotherapy and survival in 110 cats, J Small Anim Pract 50:584–592, 2009.
- Sfiligoi G, Theon AP, Kent MS: Response of nineteen cats with nasal lymphoma to radiation therapy and chemotherapy, Vet Radiol Ultrasound 48:388–393, 2007.
- Haney SM, Beaver L, Turrel J, et al: Survival analysis of 97 cats with nasal lymphoma: a multi institutional retrospective study (1986-2006), J Vet Intern Med 23:287–294, 2009.
- Little L, Patel R, Goldschmidt M: Nasal and nasopharyngeal lymphoma in cats: 50 cases (1989-2005), Vet Pathol 44:885–892, 2007.
- Greci V, Mortellaro CM, Olivero D, et al: Inflammatory polyps of the nasal turbinates of cats: an argument for designation of feline mesenchymal nasal hamartoma, J Feline Med Surg 13:213–219, 2011.
- DeLorenzi D, Bertoncello D, Bottero E: Squash preparation cytology from nasopharyngeal masses in the cat: cytological results and histological correlations in 30 cases, J Feline Med Surg 10:55–60, 2008.
- Lamb CR, Richbell S, Mantis P: Radiographic signs in cats with nasal disease, J Feline Med Surg 5(4):227–235, 2003.
- Schoenborn WC, Wisner ER, Kass PP, et al: Retrospective assessment of computed tomographic imaging of feline sinonasal disease in 62 cats, Vet Radiol Ultrasound 44(2):185–195, 2003.
- Tromblee TC, Jones JC, Etue AE, et al: Association between clinical characteristics, computed tomography characteristics, and histologic diagnosis for cats with sinonasal disease, Vet Radiol Ultrasound 47:241–248, 2006.
- Karnik K, Riechle JK, Fischetti AJ, et al: Computed tomographic findings of fungal rhinitis and sinusitis in cats, Vet Radiol Ultrasound 50:65–68, 2009.
- Mellanby RJ, Herrtage ME, Dobson JM: Long-term outcome of eight cats with non-lymphoproliferative nasal tumours treated by megavoltage radiotherapy, J Feline Med Surg 4:77–81, 2002.
- Elmslie RE, Ogilvie GK, Gillette EL, et al: Radiotherapy with and without chemotherapy for localized lymphoma in 10 cats, Vet Radiol 32:277–280, 1991.