Опухоль молочной железы — это избыточное и не контролируемое организмом разрастание тканей (клеток) молочной железы.
Рак или карцинома молочной железы — злокачественная опухоль из эпителиальной ткани молочной железы.
Сокращения: ОМЖ — опухоль молочной железы, РМЖ — ракомолочной железы
Эпидемиология и факторы риска
Эпидемиология
Опухоли молочных желез занимают третье место по частоте встречаемости среди всех новообразований у домашних кошек и составляют примерно 17% от общего числа (Dorn CR et al. 1968; Hayes HM. 1981).
Чаще всего ОМЖ диагностируют у кошек среднего и старшего возраста, с медианой в 10-12 лет. Породная предрасположенность отмечается у сиамских и домашних короткошерстных пород кошек.
Факторы риска
Самым значимым фактором в развитии ОМЖ у кошек являются женские половые гормоны. Самки имеют значительно больший риск развития опухолей молочных желез, по сравнению с самцами, а у стерилизованных кошек ОМЖ встречаются в 7 раз реже.
В одном исследовании кошки стерилизованные до наступления ими 6-ти месячного возраста имели шанс развития рака молочной железы всего 9%, а в возрасте 6-12 месяцев — 14%, по сравнению с обычными кошками (шансы развития опухоли снижались на 91% и 86% соответственно). Стерилизация после годовалого возраста никак не влияла на снижение риска развития РМЖ в будущем (Overley B. et al. 2005).
Введение эндогенных половых гормонов (мегестрола ацетат, медроксипрогестерона ацетат) для предотвращения нежелательной беременности, лечения кожных заболеваний или контроля за половой агрессией также может способствовать развитию опухолей молочных желез. Введение лекарственных препаратов на основе прогестинов приводит к фиброэпителиальной гиперплазии молочных желез. Так по данным исследования, проведенного Midsdrop et al., кошки получавшие прогестины с лечебной целью имели в 3.4 раза повышенный риск развития ОМЖ по сравнению с контрольной группой.
Опухоли молочных желез могут также встречаться и у самцов (3%), особенно если они получали препараты на основе прогестинов. Так, например, в одном исследовании 8 из 22-ух самцов с опухолями молочных желез имели в анамнезе историю применения прогестинов (Skorupski KA. et al. 2005).
Анатомия молочных желез кошек
Кошки имеют четыре пары молочных желез: 2 пары грудных и 2 пары брюшных молочных желез. В редких случаях присутствует дополнительная пара паховых молочных желез (Г.П. Дюльгер, Е.С. Седлецкая, 2018).
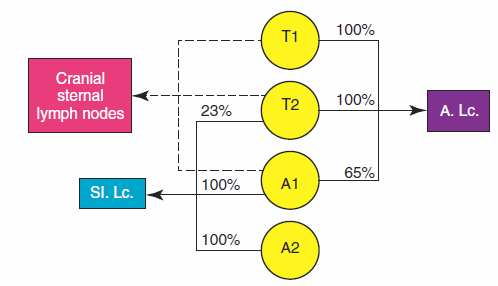
Лимфа от грудных пар молочных желез течёт в подмышечные лимфатические узлы, а от брюшных — в поверхностные паховые лимфатические узлы. В некоторых случаях, лимфа от каудальных грудных и краниальных брюшных пар молочных желез может течь в двух направлениях — в сторону подмышечного и пахового лимфатических узлов, а также в краниальный средостенный лимфатический узел. Особенность лимфооттока необходимо учитывать при планировании хирургической операции для соблюдения онкологического принципа зональности (Raharison F. et al. 2006; Raharison F. et al. 2007).
Биология опухолей молочных желез
Гистологическая характеристика
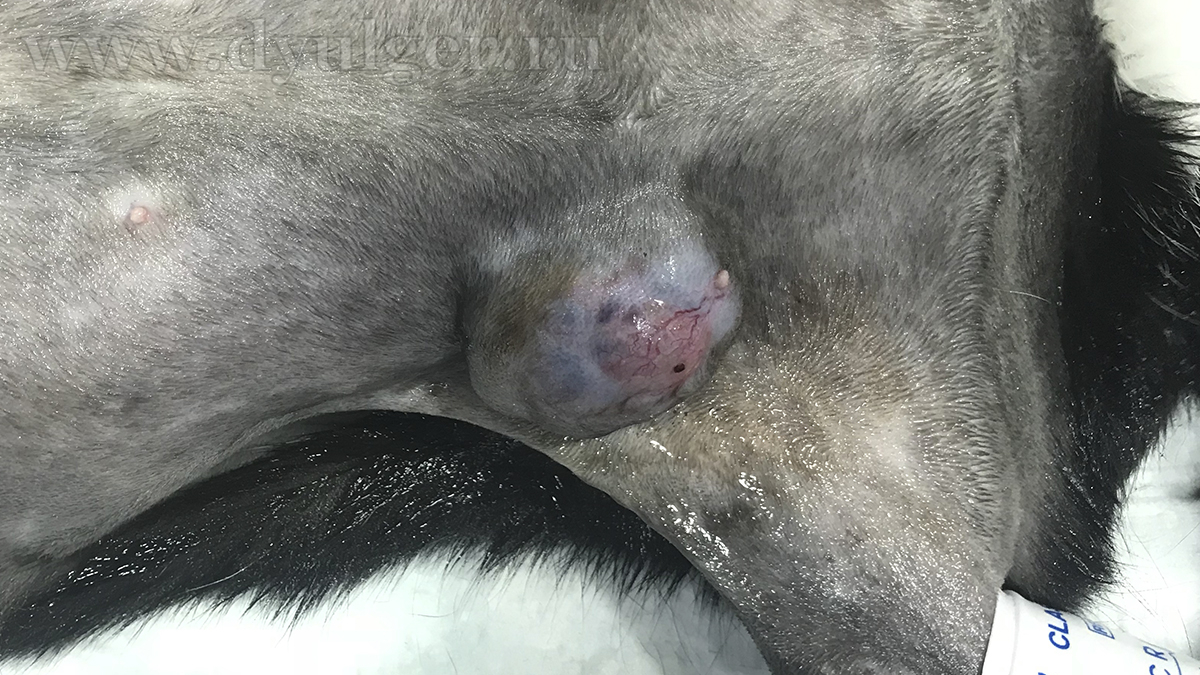
У кошек 85-95% новообразований молочных желез являются злокачественными (фото 1). Доброкачественные патологии и опухоли встречаются в 5-15% и к ним относят такие гиперпластические и диспластические процессы, как фиброэпителиальная гиперплазия, лобулярная гиперплазия, протоковая эктазия молочных желез (Hayfen DW. et al. 1971; Misdrop W. 1999), также встречаются различные виды аденом/фиброаденом.
Самая распространенная доброкачественная патология молочных желез у кошек — это фиброэпителиальная гиперплазия, развитие которой связано с избыточной пролиферацией клеток молочной железы из-за воздействия на них женских половых гормонов (прогестерона). Болезнь может развиваться на фоне применения лекарственных средств на основе прогестинов или у беременных или бесплодных самок в возрасте до года. В отличие от новообразований, данная патология самостоятельно регрессирует после прекращения воздействия на ткань молочной железы прогестерона (Дюльгер Г.П. и соавторы, 2019) (фото 2).
Среди злокачественных процессов у кошек преобладают эпителиальные новообразования, однако могут встречаться саркомы и другие неэпителиальные опухоли (мастоцитома, лимфома) молочных желез. Большинство карцином развиваются из люминарного эпителия протоков и альвеол. Опухоли смешанного происхождения встречаются реже. Чаще всего карциномы молочных желез у кошек тубулярно-папиллярного, солидного и анапластического типа. К более редким типам относят липидосодержащую карциному, муцинозную карциному, веретеноклеточную карциному и карциному с плоскоклеточной дифференциацией. У кошек также встречаются воспалительные карциномы, но гораздо реже чем у собак (Withrow SJ. et al. 2013; Zappulli V. et la. 2013; Seixas F. et al. 2008; Perez-Alenza MD. et al. 2004).
Гормоны
Очевидно, что риск развития опухолей молочных желез у кошек связан с воздействием эстрогенов, однако точная их роль в туморогенезе неизвестна. Как и у всех млекопитающих, женские половые гормоны необходимы для развития молочных желез и воздействуют на них как митогены, которые индуцируют пролиферацию потокового эпителия.
По данным ряда исследований, эстрогены и их метаболиты могут оказывать токсическое воздействие на гены клеток, а прогестерон симулирует продукцию гормона роста и увеличивает количество рецепторов к нему на клетках молочной железы, данные процессы участвуют в образовании опухолей и их злокачественном перерождении (Withrow SJ. et al. 201; Russo K. et al. 2006; Okoh V. et al 2011; Mol JA., et al., 1999; van Garderen E. et al., 2002).
Вероятно, что на развитие опухолей молочных желез у кошек, влияют эстрогены и факторы роста, как и у других видов животных, однако, скорее всего, существуют и другие факторы влияющие на этот процесс.
Сравнительные аспекты
Исследования показали, что экспрессия гормональных рецепторов на клетках карциномы (рака) молочной железы, встречается у кошек гораздо реже, по сравнению с собаками или людьми.
У людей с раком груди экспрессия рецепторов к эстрогену и прогестерону встречается в 70-80% случаев и только у 15-20% раковых опухолей отсутствую рецепторы к обоим гормонам (Zatrani D. et al. 2000). Для сравнения, у кошек экспрессия эстрогеновых и прогестероновых рецепторов отмечается в 7-22% и 33% от всех случаев рака молочных желез (Rutterman GR et al. 1991; Millanta E. et al, 2005; de las Mulas JM. et la. 2000; Mulas JMD. et al. 2002; Hamilton JM. et la. 1976).
У людей с отсутствием рецепторов к эстрогенам, также часто отмечается негативная экспрессия (отсутствие) рецепторов к эпидермальному фактору роста-2 (HER2) на клетках рака груди. Такие опухоли характеризуются агрессивным течением и носит название тройного негативного рака молочной железы. У кошек экспрессия HER2 отмечается в 16-17% и 58% раковых опухолей молочной железы не имеют всех трех рецепторов на клетках опухоли (Wiese DA. et la. 2013; Ordas J. et .al. 2007). Такие кошки могу быть сравнительной моделью для поиска эффективной таргетной терапии, которая отсутствует у людей с тройным негативным раком груди.
Изучение экспрессии рецепторов к рапамицину может быть полезно для дальнейшего изучения таргетной терапии ингибиторами этих рецепторов — рапамицину (Рапамун, Сиролимус).
Мутация генов BRCA1 и BRCA2 повышает риски развития рака груди у женщин, так как эти гены являются генами-супрессорами опухолей и вырабатывают белки, которые участвуют в восстановлении поврежденной ДНК. Дисфункция этих генов увеличивает риск развития рака молочной железы и яичников и встречается в 5-10% раковых опухолей молочных желез у женщин. Распространенность аналогичных мутаций генов у кошек до конца не изучено и требует дальнейших исследований (Wiese DA. et al. 2013).
Клиническая картина и диагностика опухолей молочных желез
Анамнез и симптомы
Чаще всего в анамнезе отмечается хроническое использование прогестинов, отсутствие стерилизации (овариоэктомии) и неактивный репродуктивный статус (отсутствие родов) или проведение кастрации кошки в возрасте более 1 года.
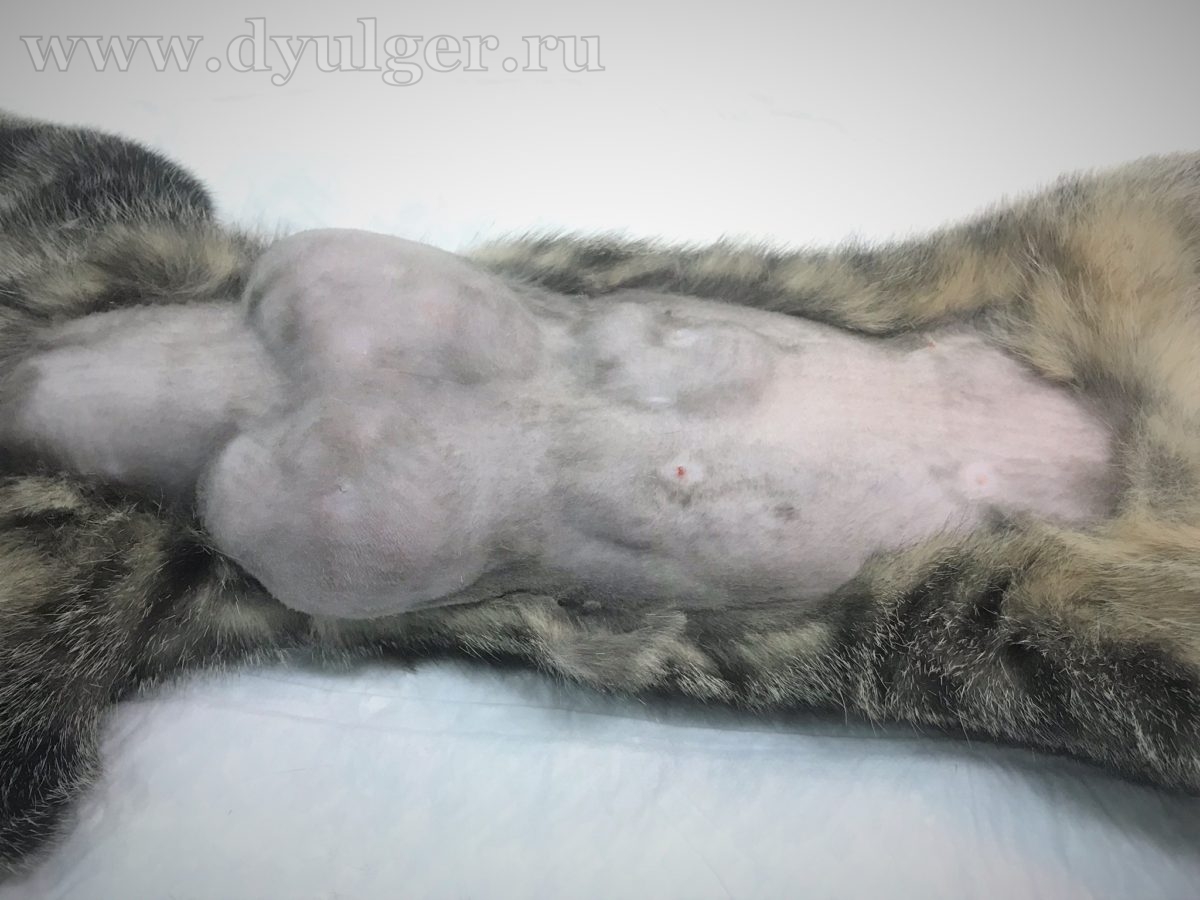
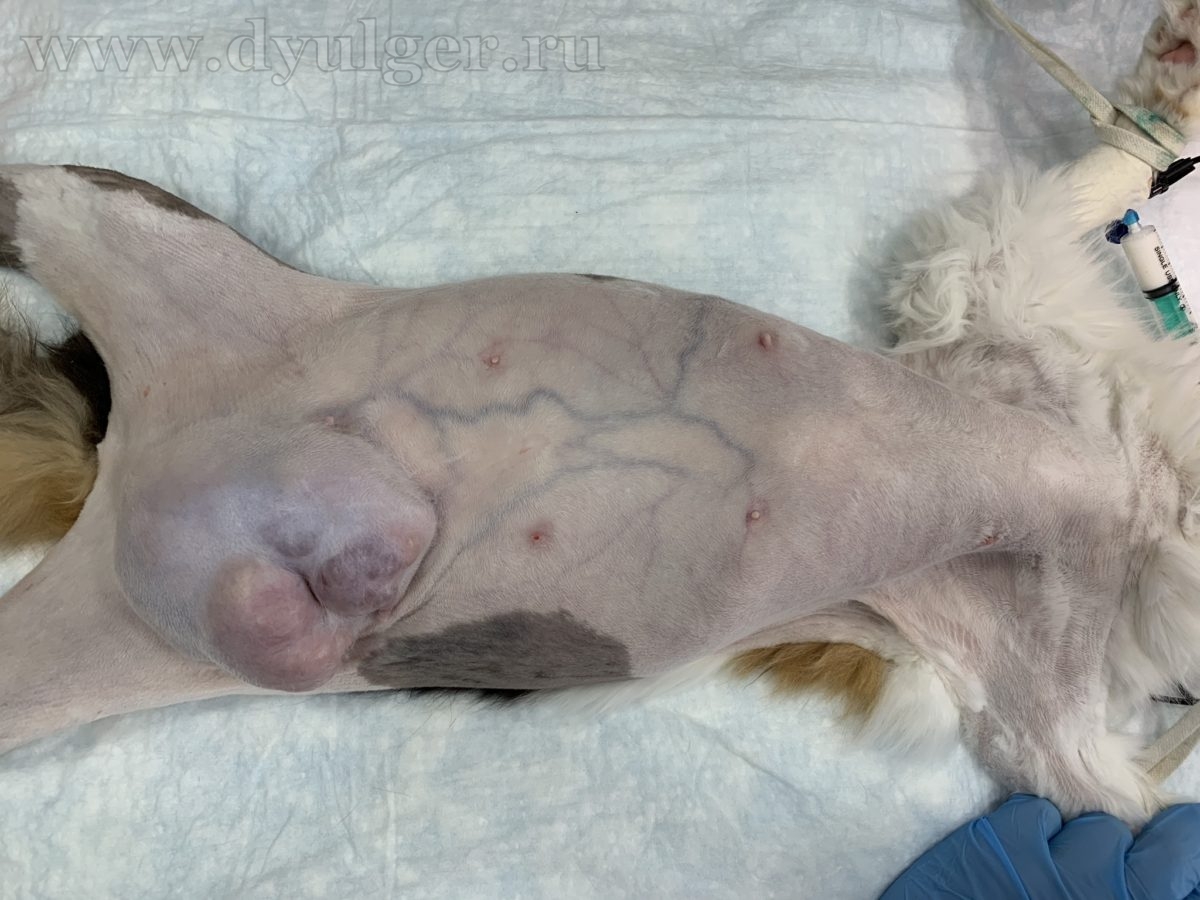
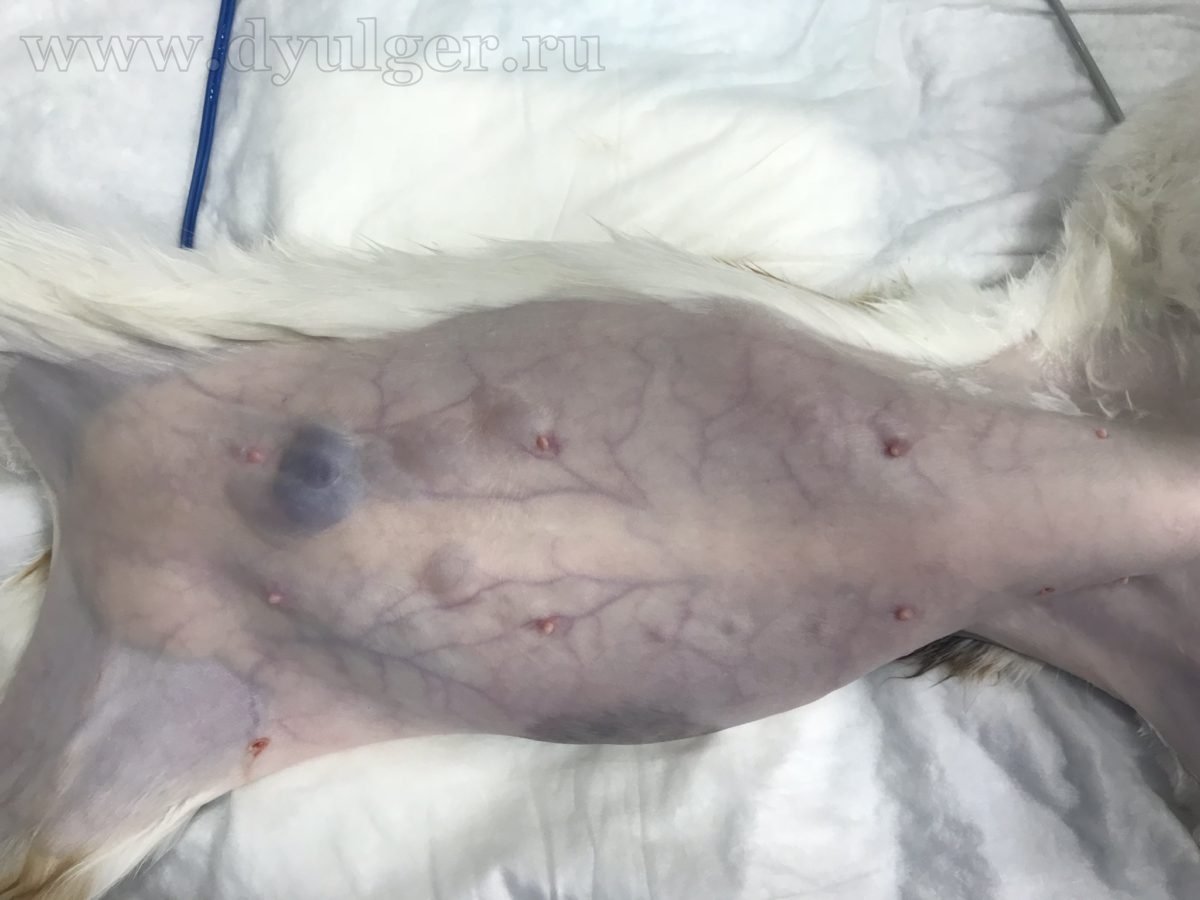
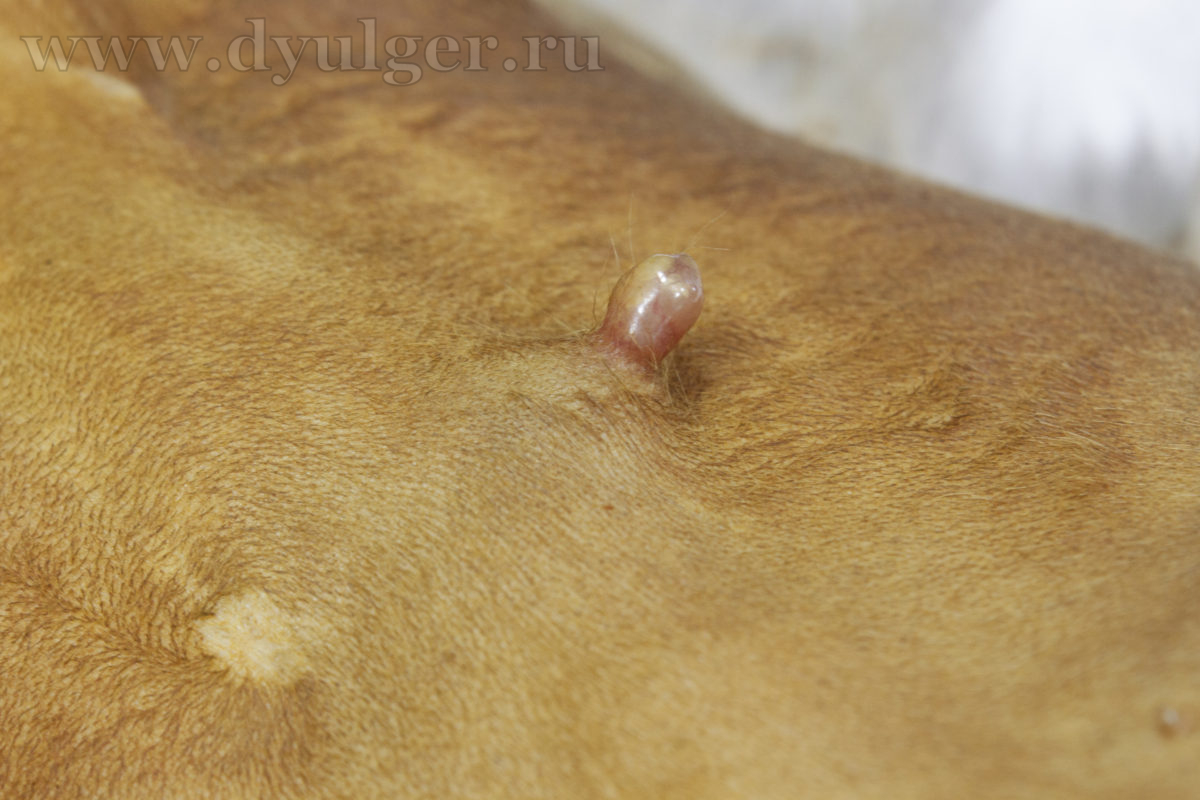
Внешне опухоли выглядят как округлые, плотные массы, растущие из ткани молочной железы (фото 3), у 60% кошек отмечаются множественные поражения (фото 4). Из рядом расположенные соски могут быть увеличены и выделять различный по виду экссудат (фото 5).
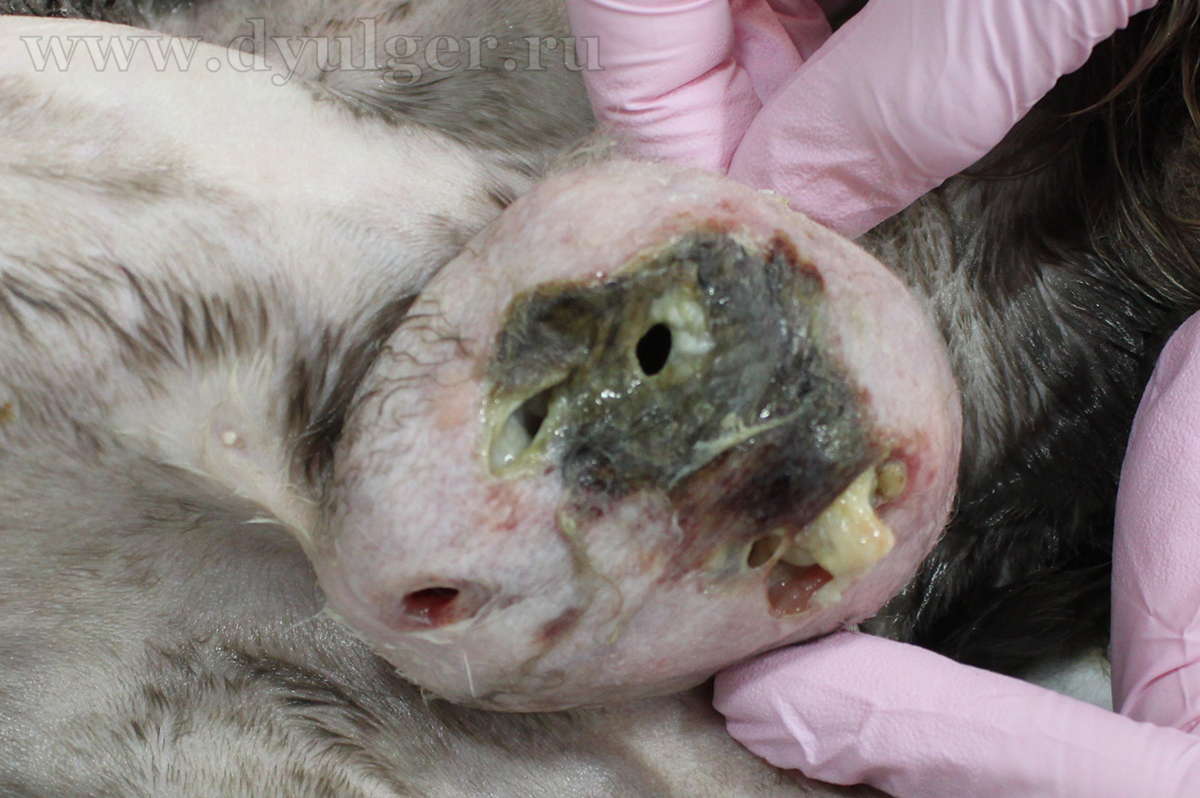
Большие по объему опухоли могут выглядеть воспаленными или иметь на своей поверхности изъязвления (фото 6), истинные воспалительные карциномы у кошек встречаются крайне редко.
Клинически сложно отличить злокачественную опухоль от доброкачественной, признаками рака являются быстрый рост, воспаление/изъязвление/некроз, инвазия в окружающие ткани опухоли и увеличение в размерах паховых, подмышечных или других лимфатических узлов.
Кошки могут также поступать с отеком тазовых конечностей из-за наличия опухолевых тромбов в бедренных артериях или замедления венозного оттока по бедренным венам (Gimenez F. et la. 2010).
Постановка диагноза и стадирование
Для точной верификации происхождения опухоли необходимо провести цитологическое или гистологическое исследование новообразования.
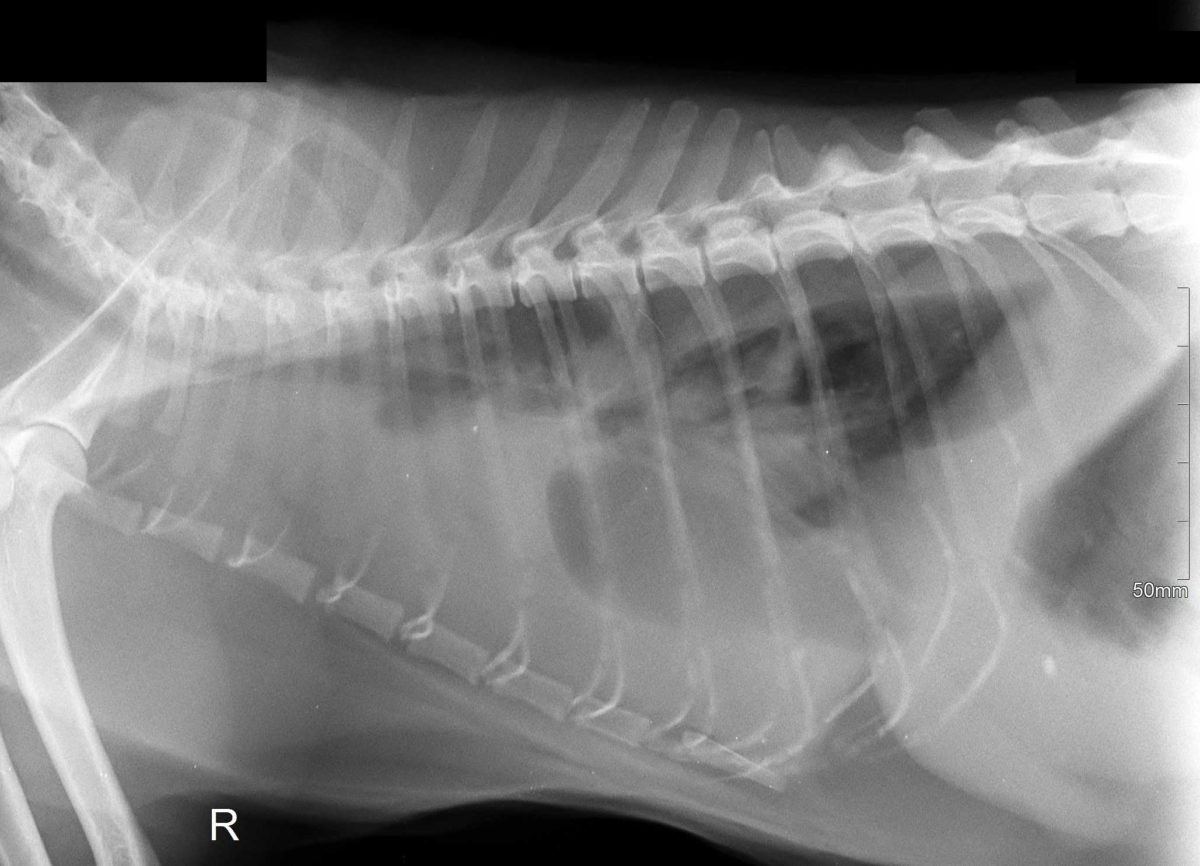
Стадирование (определение стадии) необходимо проводить всем животным со злокачественными опухолями молочных желез. Самыми частыми местами метастазирования являются подмышечные и паховые лимфатические узлы, легкие, плевральная полость (фото 8) и печень.
Для определения стадии проводят клинический осмотр животного, рентгенографию грудной клетки в нескольких проекциях (фото 7), ультразвуковое исследование органов брюшной полости и биопсию новообразования и/или измененного регионарного лимфатического узла. В ряде случаев прибегают к компьютерной томографии, которая является более чувствительным методом поиска метастазов и определения границ опухоли.
Клинический и биохимический анализы крови/мочи позволяют оценить общее состояние организма и возможность проведения анестезии.
Вышеперечисленные исследования и анализы также позволяют исключить или подтвердить наличие сопутствующих заболеваний и понять насколько целесообразным является лечения рака молочных желез у данного пациента.

Стадии рака молочных желез у кошек
- T — максимальный диаметр опухоли в сантиметрах;
- N0 — нету метастазов в регионарных лимфатических узлах, а N1 — есть;
- M0 — нету метастазов в отдаленных органах, M1 — есть.
| Стадия | Размер опухоли | Состояние лимфатических узлов | Отдаленные метастазы |
|---|---|---|---|
| I | T1 <2 см | N0 | M0 |
| II | T2 2-3 см | N0 | M0 |
| III | T1 или T2 T3 > 3 см | N1 N0 или N1 | M0 M0 |
| IV | Любой | Любой | M1 |
Прогноз у кошек с опухолями молочных желез
Клинические факторы
Для большинства кошек с раком молочных желез прогноз осторожный, смерть обычно наступает от прогрессирования основного заболевания или метастазирования в жизненно важные органы.
Прогноз в каждом конкретном случае зависит от множества факторов (размера опухоли, стадии заболевания, гистологической степени злокачественности, митотического индекса), но в среднем от момента диагноза до гибели проходит 10-12 месяцев (Lana et al., 2007).
Размер опухоли имеет важное прогностическое значение, так животные с опухолью диаметром менее 2 сантиметров, после хирургического лечения имеют медиану продолжительности жизни более 2 лет (MacEwen EG et al., 1984), а животные с диаметром опухоли 3 сантиметра — 4-12 месяцев (Viste JR et al. 2002).
Состояние лимфатических узлов тоже важный проностический фактор, например в одном исследовании, если у кошки обнаруживали метастазы в регионарных лимфатических узлах, то ее продолжительность жизни была не более 9 месяцев после операции (Seixas F et al., 2011).
Клиническая стадия рака молочных желез, также является показательной, так кошки с I, II, III и IV стадией имеют медиану продолжительности жизни 29, 12,5, 9 и 1 месяц соответственно (Ito T et al., 1996).
График послеоперационной продолжительности жизни кошек с раком молочных желез (месяцы после операции и процент выживших животных), у которых были обнаружены (синий) или отсутствовали (красный) метастазы в лимфатических узлах.
Гистологические факторы
Степень дифференцировки рака молочной железы является важным прогностическим фактором, как у людей и собак, так и у кошек.
Например в одном исследовании все кошки с высокодифференцированными опухолями были живы через год после операции и ни одно животное не прожило больше года с низкодифференцированными опухолями молочных желез (Castagnaro M et al., 1998).
В другом исследовании годичная выживаемость для кошек с высоко-, средне- и низкодифференцированными опухолями составила 100%, 70% и 10% соответственно, а медиана продолжительности жизни для животных с высоко- и низкодифференцированными опухолями составила 36 и 6 месяцев (Seixas F et al., 2011).
На продолжительность жизни также влияет инвазия опухоли в лимфатические и кровеносные сосуды, метастазы в лимфатических узлах, высокий митотический индекс.
Сводная таблица прогностических факторов
МПЖ — медиана продолжительности жизни
| Фактор | Описание |
|---|---|
| Диаметр опухоли | До 3 см — МПЖ 21-24 месяца Более 3 см — МПЖ 4-12 месяцев |
| Клиническая стадия | I стадия — 29 месяцев II стадия — 12,5 месяцев III стадия — 9 месяцев IV стадия — 1 месяц |
| Объем операции | Радикальная мастэктомия снижает частоту рецидивирования, по сравнению с простой мастэктомией или лампэктомией |
| Гистологическая степень злокачественности | Высокодифференцированная опухоль — 100% животных живут больше года после операции Низкодифференцированная опухоль — 0% животных живот больше года после операции |
| Индекс митоза | Менее 2 митозов — длительная продолжительность жизни |
Лечение опухолей молочных желез у кошек
Хирургическая операция
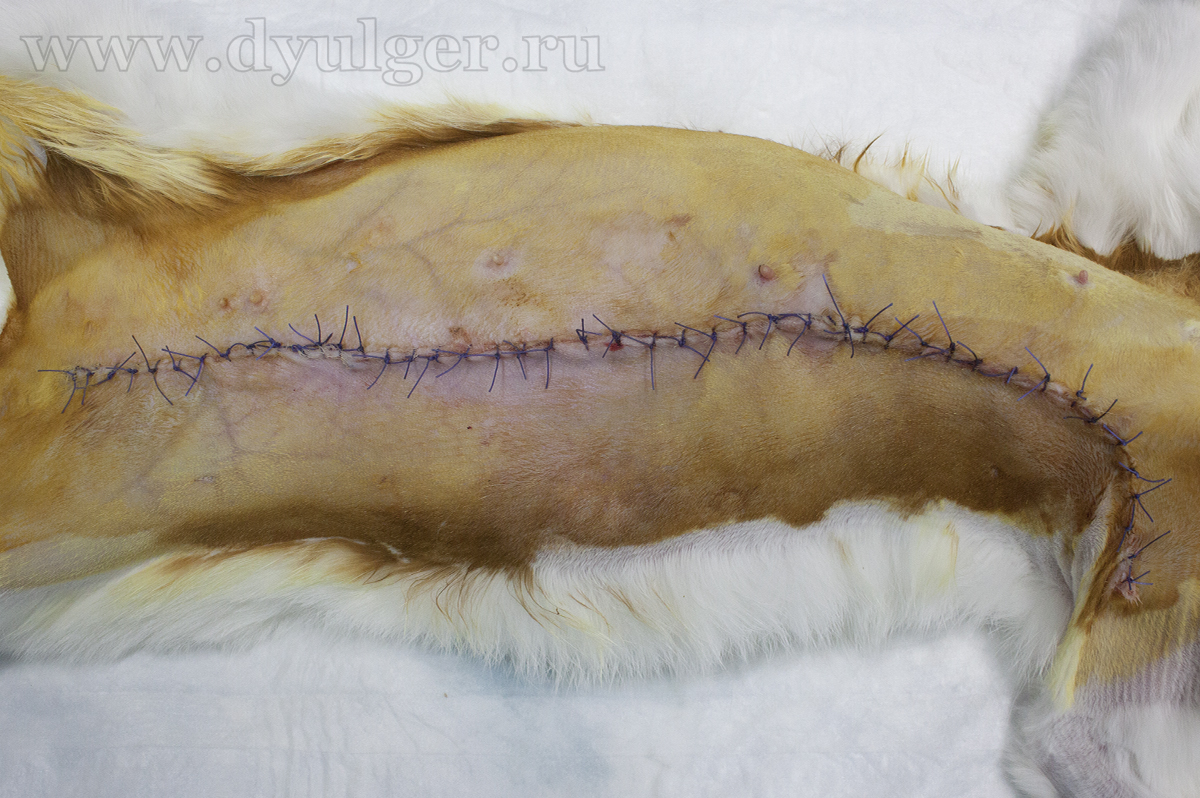
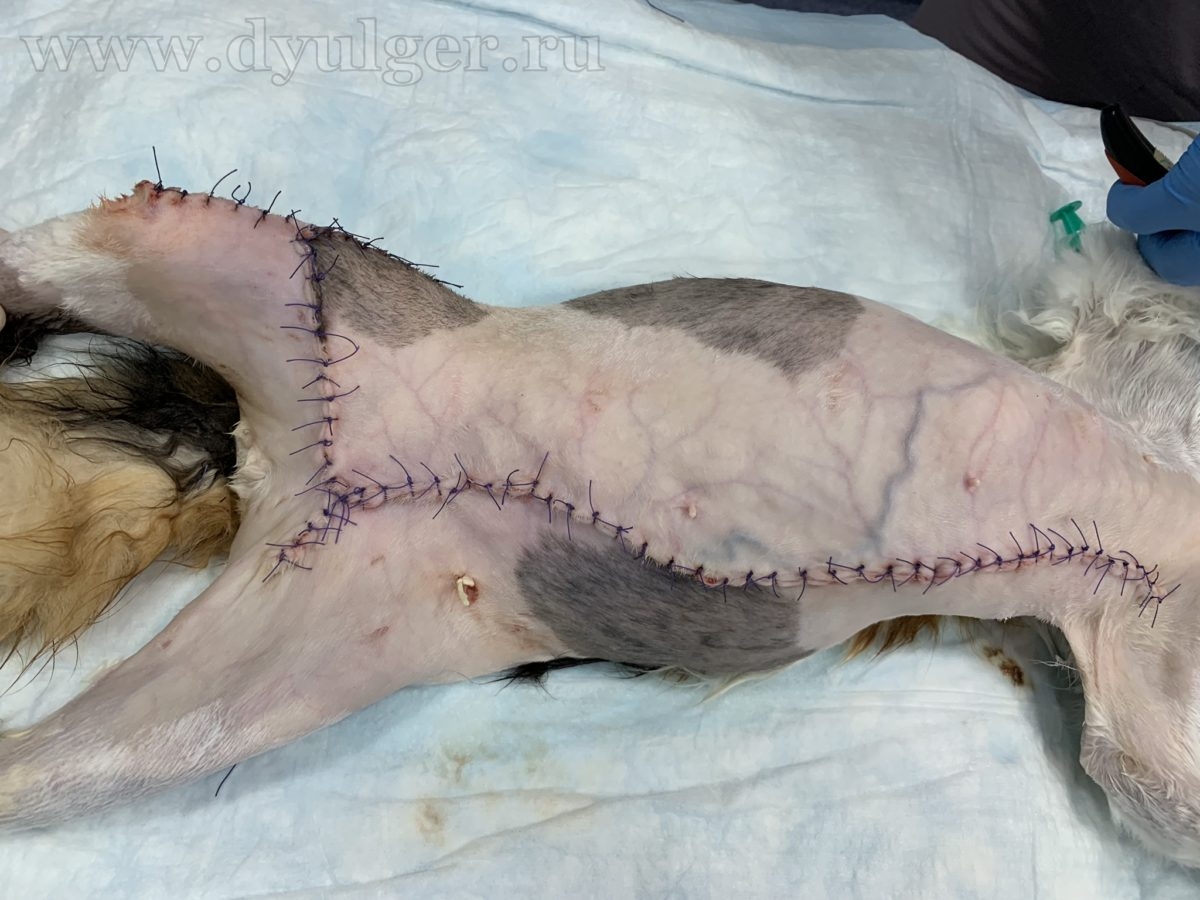
Оперативное удаление опухолей молочных желез является самым эффективным способом лечения ОМЖ у кошек, которое заключается в унилатеральной мастэктомии (фото 9) — удалении ВСЕХ молочных желез с одной стороны или билатеральной мастэктомии (фото 10) — удаление ВСЕХ молочных желез с двух сторон в два этапа (сначала удаляют молочные железы с одной стороны, а через несколько недель с другой стороны) (Lana SE et al., 2007; McNeill CJ et al., 2009; MacEwen EG et al., 1984).
Проведение менее радикальных операций (простая мастэктомия, лампэктомия) не рекомендовано, так как связано с повышенной частотой локального рецидивирования опухоли и сниженной медианой продолжительности жизни (MacEwen EG et al., 1984).
В большинстве случаев для увеличения продолжительности жизни проводят удаление регионарных лимфатических узлов.
Системная терапия
Гормональная и таргетная терапия часто используется в гуманной медицине при лечении рака молочных желез. Применение ее у кошек редко оправдано, отчасти это связано с высокой стоимостью и малой доступностью исследований для определения рецепторов эстрогена и прогестерона, а также экспрессии HER2 белка. С другой стороны, по данным ряда исследований, большинство опухолей молочных желез кошек негативны по этим маркерам, что делает таргетную терапию малоперспективной.
В связи с этим, на данный момент, большинство исследований и авторов рекомендуют использование традиционной химиотерапии в качестве адъювантного лечения у кошек с РМЖ.
Основными показаниями к использованию химиотерапии являются:
- Опухоли более 3 сантиметров в диаметре;
- Низкодифференцированные новообразования;
- Наличие метастазов в лимфатических узлах;
- III или IV стадия заболевания.
Самым распространенным препаратом для химиотерапии у кошек является доксорубицин. По данным целого ряда исследований использование химиотерапии в сочетании с хирургической операцией у кошек с III или менее стадией ОМЖ позволяет добиться медианы продолжительности жизни в 460 и более суток (McNeil CJ et al., 2009; Borrego JF et al., 2009; Novosad CA et al., 2006). Основные минусы этих исследований заключаются в маленькой выборке животных, отсутствие контрольных групп и большом разнообразии клинических стадий и гистологических степеней дифференцировки опухолей молочных желез, которые значительно влияют на продолжительность жизни.
На данный момент унилатеральная мастэктомия является методом выбора для локального контроля за новообразованием, а адъювантная терапия используется у животных с II и III стадией заболевания или низкодифференцированными опухолями.
Частые вопросы по опухолям молочных желез у кошек
Необходимо показать животное ветеринарному врачу с онкологической специализацией.
В таких случаях опухоль обрабатывают антисептическими растворами (хлоргексидин, мирамистин). Не рекомендовано использовать ранозаживляющие мази (они могут провоцировать опухолевый рост) и такие антисептики, как перекись водорода или содержащие йод, бриллиантовый зеленый (зелёнка) и спирт.
При вторичном инфицировании опухоли может потребоваться системная антибиотикотерапия.
Факторов влияющих на продолжительность жизни много (стадия и дифференцировка опухоли, сопутствующие болезни и другие). Поэтому длительность жизни сильно различается и может составлять от 1 месяца до 29 месяцев и более при комплексном и своевременном лечении.
Данных «лекарств» очень много, но они никак не влияют на саму опухоль. Отсутствую объективные доказательства и исследования их работы. Попытка их использования приведет к лишней потере времени.
Особого ухода не требуется, в ряде случаев для защиты от самотравмирования на животное надевают попону. Животным с опухолевыми заболеваниями требуется сбалансированное и полнорационное питание.
На данный момент единственной профилактикой развития рака молочных желез у кошек является ранняя стерилизация (удаление яичников) животного.
Так например, в одном исследовании кошки стерилизованные до наступления ими 6-ти месячного возраста имели шанс развития рака молочной железы всего 9%, а в возрасте 6-12 месяцев — 14%, по сравнению с обычными кошками (шансы развития опухоли снижались на 91% и 86% соответственно). Стерилизация после годовалого возраста никак не влияла на снижение риска развития РМЖ в будущем (Overley B. et al. 2005).
Большинство животных хорошо переносят мастэктомию и они возвращаются к полноценной жизни через пару недель после операции.
В послеоперационном периоде на кошку надевают попону до снятия швов, дают внутрь обезболивающие и противовоспалительные средства, местно обрабатывают шов антисептическим раствором. Швы снимают примерно через две недели. Осложнения встречаются редко и обычно связаны с продвинутой стадии заболевания до операции.
Цена операции у кошек варьируется и зависит от ряда факторов: стадия заболевания, состояние здоровья, оборудование клиники, методика операции, используемые расходные материалы и другие.
Самый простой способ узнать цену операции — позвонить в ветеринарное учреждение и уточнить ее у администратора (не забудьте узнать ПОЛНУЮ стоимость операции, куда входит и сама операция и наркоз и все остальное).
Литература
Научные статьи
- Фброэпителиальная гиперплазия молочных желез у кошек. Дюльгер Г.П., Дюльгер П.Г., Седлецкая Е.С., Акчурина И.В., Латынина Е.С., Семиволос А.М. Ветеринария и зоотехния. 2019. № 1. С. 39-43
- Dorn CR, Taylor DO, Frye FL, et al: Survey of animal neoplasms in Alameda and Contra Costa Counties, California. I. Methodology and description of cases. J Natl Cancer Inst 40:295–305, 1968.
- Dorn CR, Taylor DO, Schneider R, et al: Survey of animal neoplasms in Alameda and Contra Costa Counties, California. II. Cancer morbidity in dogs and cats from Alameda County. J Natl Cancer Inst 40:307–318, 1968.
- Hayes HM, Jr, Milne KL, Mandell CP: Epidemiological features of feline mammary carcinoma. Vet Rec 108:476–479, 1981.
- Hayden DW, Nielsen SW: Feline mammary tumours. J Small Anim Pract 12:687–698, 1971.
- Misdorp W, Else R, Hellmen E, et al: Histological classification of mammary tumors of the dog and the cat, Washington, DC, 1999, American Registry of Pathology.
- Overley B, Shofer FS, Goldschmidt MH, et al: Association between ovarihysterectomy and feline mammary carcinoma. J Vet Intern Med 19:560–563, 2005.
- Misdorp W, Romijn A, Hart AA: Feline mammary tumors: a case-control study of hormonal factors. Anticancer Res 11:1793–1797, 1991.
- Skorupski KA, Overley B, Shofer FS, et al: Clinical characteristics of mammary carcinoma in male cats. J Vet Intern Med 19:52–55, 2005.
- Raharison F, Sautet J: Lymph drainage of the mammary glands in female cats. J Morphol 267:292–299, 2006.
- Raharison F, Sautet J: The topography of the lymph vessels of mammary glands in female cats. Anat Histol Embryol 36:442–452, 2007.
- Lana SE, Rutteman GR, Withrow SJ: Tumors of the mammary gland. In Withrow SJ, Vail DM, editors: Small animal clinical oncology, St Louis, 2007, Elsevier, pp 619–636.
- MacEwen EG, Hayes AA, Harvey HJ, et al: Prognostic factors for feline mammary tumors. J Am Vet Med Assoc 185:201–204, 1984.
- Viste JR, Myers SL, Singh B, et al: Feline mammary adenocarcinoma: tumor size as a prognostic indicator. Can Vet J 43:33–37, 2002.
- Seixas F, Palmeira C, Pires MA, et al: Grade is an independent prognostic factor for feline mammary carcinomas: a clinicopathological and survival analysis. Vet J 187:65–71, 2011.
- Ito T, Kadosawa T, Mochizuki M, et al: Prognosis of malignant mammary tumor in 53 cats. J Vet Med Sci 58:723–726, 1996.
- Castagnaro M, Casalone C, Bozzetta E, et al: Tumour grading and the one-year postsurgical prognosis in feline mammary carcinomas. J Comp Pathol 119:263–275, 1998.
- Seixas F, Palmeira C, Pires MA, et al: Grade is an independent prognostic factor for feline mammary carcinomas: a clinicopathological and survival analysis. Vet J 187:65–71, 2011.
- McNeill CJ, Sorenmo KU, Shofer FS, et al: Evaluation of adjuvant doxorubicin-based chemotherapy for the treatment of feline mammary carcinoma. J Vet Intern Med 23:123– 129, 2009.
- MacEwen EG, Hayes AA, Harvey HJ, et al: Prognostic factors for feline mammary tumors. J Am Vet Med Assoc 185:201–204, 1984.
- Borrego JF, Cartagena JC, Engel J: Treatment of feline mammary tumours using chemotherapy, surgery and a COX-2 inhibitor drug (meloxicam): a retrospective study of 23 cases (2002-2007). Vet Comp Oncol 7:213–221, 2009;
- Novosad CA, Bergman PJ, O’Brien M, et al: Retrospective evaluation of adjunctive doxorubicin for the treatment of feline mammary gland adenocarcinoma: 67 cases. J Am Anim Hosp Assoc 42:110–120, 2006.
- Withrow SJ, Vail DM, Page R: Withrow and MacEwen’s small animal clinical oncology (Kindle Location 31795). Elsevier Health Sciences 2013. Kindle Edition.
- Zappulli V, Caliari D, Rasotto R, et al: Proposed classification of the feline “complex” mammary tumors as ductal and intraductal papillary mammary tumors. Vet Pathol 50:1070–1077, 2013.
- Seixas F, Palmeira C, Pires MA, et al: Are complex carcinoma of the feline mammary gland and other invasive mammary carcinoma identical tumours? Comparison of clinicopathologic features, DNA ploidy and follow-up. Res Vet Sci 84:428–433, 2008.
- Seixas F, Pires MA, Lopes CA: Complex carcinomas of the mammary gland in cats: pathological and immunohistochemical features. Vet J 176:210–215, 2008.
- Perez-Alenza MD, Jimenez A, Nieto AI, et al: First description of feline inflammatory mammary carcinoma: clinicopathological and immunohistochemical characteristics of three cases. Breast Cancer Res 6:R300–R307, 2004.
- Russo J, Russo IH: The role of estrogen in the initiation of breast cancer. J Steroid Biochem Mol Biol 102:89–96, 2006.
- Okoh V, Deoraj A, Roy D: Estrogen-induced reactive oxygen species-mediated signalings contribute to breast cancer. Biochim Biophys Acta 1815:115–133, 2011.
- Mol JA, Lantinga-van Leeuwen IS, van Garderen E, et al: Mammary growth hormone and tumorigenesis—lessons from the dog. Vet Q 21:111–115, 1999.
- van Garderen E, Schalken JA: Morphogenic and tumorigenic potentials of the mammary growth hormone/growth hormone receptor system. Mol Cell Endocrinol 197:153–165, 2002.
- Zafrani B, Aubriot MH, Mouret E, et al: High sensitivity and specificity of immunohistochemistry for the detection of hormone receptors in breast carcinoma: comparison with biochemical determination in a prospective study of 793 cases. Histopathology 37:536–545, 2000.
- Rutteman GR, Blankenstein MA, Minke J, et al: Steroid receptors in mammary tumours of the cat. Acta Endocrinol (Copenh) 125(Suppl 1):32–37, 1991.
- Millanta F, Calandrella M, Bari G, et al: Comparison of steroid receptor expression in normal, dysplastic, and neoplastic canine and feline mammary tissues. Res Vet Sci 79:225– 232, 2005.
- de las Mulas JM, van Niel M, Millán Y, et al: Immunohistochemical analysis of estrogen receptors in feline mammary gland benign and malignant lesions: comparison with biochemical assay. Domest Anim Endocrinol 18:111–125, 2000.
- Mulas JMD, Van Niel M, Millán Y, et al: Progesterone receptors in normal, dysplastic and tumourous feline mammary glands. Comparison with oestrogen receptors status. Res Vet Sci 72:153–161, 2002.
- Hamilton JM, Else RW, Forshaw P: Oestrogen receptors in feline mammary carcinoma. Vet Rec 99:477–479, 1976.
- Wiese DA, Thaiwong T, Yuzbasiyan-Gurkan V, et al: Feline mammary basal-like adenocarcinoma: a potential model for human triplenegative breast cancer (TNBC) with basal-like subtype. BMC Cancer 13:403, 2013.
- Ordas J, Millan Y, Dios R, et al: Protooncogene HER2 in normal, dysplastic and tumorous feline mammary glands: an immunohistochemical and chromogenic in situ hybridization study. BMC Cancer 7:179–184, 2007.
- Giménez F, Hecht S, Craig LE, et al: Early detection, aggressive therapy: optimizing the management of feline mammary masses. J Feline Med Surg 12:214–224, 2010.
Более подробно с этими статьями вы можете ознакомиться на сайте PubMedCentral.
Книги
- Дюльгер Г.П., Седлецкая Е.С. Акушерство, гинекология и биотехника размножения кошек, Учебник, 2018.
- Susan Little. August’s Consultations in Feline Internal Medicine, Volume 7 (1st Edition), 2015;